Фашина — это… Что такое Фашина?
ФАШИНА — (нем. и фр., от лат. fascis пук, связка). Связка хвороста, сноп, вязанка прутьев, которыми застилают дороги в болотистых местах; в военном деле, фашинами заваливают рвы, при постройках батарей, кладут под насыпи, для скорости работы. Фашинная… … Словарь иностранных слов русского языка
фашина — карабура, связка, пучок Словарь русских синонимов. фашина сущ., кол во синонимов: 3 • карабура (2) • пучок … Словарь синонимов
фашина — Пучок хвороста в форме цилиндра, перевязанный гибкими прутьями вицами или мягкой проволокой [Терминологический словарь по строительству на 12 языках (ВНИИИС Госстроя СССР)] фашина Пучки хвороста, металлической или синтетической сетки,… … Справочник технического переводчика
ФАШИНА — (нем. Faschine от лат. fascis связка прутьев, пучок), туго стянутая связка хвороста, используемая главным образом для укрепления откосов гидротехнических сооружений, а также при строительстве оборонительных сооружений … Большой Энциклопедический словарь
ФАШИНА — ФАШИНА, фашины, жен. (нем. Faschine от лат. fascis пучок) (спец.). Связка прутьев, хвороста, употребляемая для укрепления насыпей, прокладки дорог по болоту, при сооружении плотин и т.п. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
(нем. Faschine от лат. fascis пучок) (спец.). Связка прутьев, хвороста, употребляемая для укрепления насыпей, прокладки дорог по болоту, при сооружении плотин и т.п. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ФАШИНА — ФАШИНА, ы, жен. (спец.). Связка прутьев, хвороста, камыша для укрепления откосов, насыпей, дорог по болоту, для вязки плотов. | прил. фашинный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ФАШИНА — жен., франц. связка хворосту, вязанка прутьев, сноп; кубыш, кубач; фашинами войско загачивает топкие места, кладет для спорости под насыпи батарей, заваливает рвы и пр. Вязать фашины. Фашинная насыпь. Фашинная градировка рассолу, пропуск его… … Толковый словарь Даля
фашина — ы, ж. fascine f.> нем. Faschine. Один из связанных пучков хвороста, употребляемых в дорожном строительстве для укрепления насыпей, плотин и т. п. БАС 1. Которые багинеты не только что против неприятеля будут изрядны, но еще иной есть в них… … Исторический словарь галлицизмов русского языка
п. БАС 1. Которые багинеты не только что против неприятеля будут изрядны, но еще иной есть в них… … Исторический словарь галлицизмов русского языка
фашина — ы; ж. [нем. Faschine из лат.] Спец. Пучок хвороста, камыша, перевязанный прутьями или скрученный проволокой (применяется для укрепления насыпей, плотин, дорог по болоту, оборонительных сооружений, для вязки плотов). Поставить фашины. Укрепить… … Энциклопедический словарь
ФАШИНА — пучок хвороста в форме цилиндра, перевязанный гибкими прутьями вицами или мягкой проволокой (Болгарский язык; Български) фашина (Чешский язык; Čeština) naťový váleček (Немецкий язык; Deutsch) Faschine (Венгерский язык; Magyar) rözsehenger… … Строительный словарь
Машины для укладки фашин и гатей . Танки. Иллюстрированная энциклопедия. Часть 1
Танк «Черчилль», оборудованный бобиной с настильными гатями в передней части корпуса и дополнительными противопыльными насадками на воздухозаборник двигателя в корме. Гать разматывалась с бобины, и танк своей массой утрамбовывал ее, готовя пригодный для движения путь по сыпучему грунту.
Гать разматывалась с бобины, и танк своей массой утрамбовывал ее, готовя пригодный для движения путь по сыпучему грунту.
Фашина как элемент инженерного вооружения известна с древних времен, и в годы Первой мировой войны к этой идее вернулись применительно к танкам. Применяли их простейшим способом — сбрасывали в широкие рвы и делали их проходимыми для тяжелых бронированных машин. Во Второй мировои войне подход не претерпел существенных изменений. Фашины изготавливались следующим методом — стволы срубленных не очень толстых деревьев очищали от веток и связывали в большие вязанки длиной 3,35 м или немногим более и диаметром от 1,8 до 2,4 м. Эти фашины закрепляли на корпусе специальных машин при помощи тросов, кабелей или механических держателей. Поскольку фашины закреплялись в носовой части машины, у механика-водителя возникали проблемы с обзором. Попытки применить специальные перископы не оправдались, в результате решили крепить фашины таким образом, чтобы не закрывать поле зрения механика-водителя.
Штурмовое приспособление
Иногда фашины применяли для прокладки путей на заболоченных, сыпучих или иных труднопроходимых участках. Например, на танк «Черчилль» устанавливалась связка из нескольких фашин, связанных последовательно и скрученных в рулон. Подойдя к «проблемному» участку, рулон сбрасывался и разматывался по мере движения по нему танка. Таким образом, танк своей массой вдавливал фашины в грунт и появлялась временная дорога. Длина одного рулона достигала 30,5 м. Разновидностью фашин стали настильные гати из бревен, принцип использования был практически идентичен. Впоследствии появились два основных варианта фашин и гатей — первый по своей ширине накрывал весь участок будущего пути и равнялся 3 — 3,5 м, а второй состоял из двух нешироких (по 1,2 — 1,6 м) фашин, намотанных на большие бобины, которые раскладывались по ширине колеи. Оба типа обеспечивали движение как колесных, так и гусеничных машин. Такие фашины применялись в боях под Дьеппе в 1942 году.
На базе танка «Шерман»
Большинство фашин и гатей транспортировалось на танках «Черчилль», однако вскоре для этой цели приспособили и танки «Шерман» — специальные машины на их базе получили название «Краб». Вместо снятой башни устанавливали длинный рычаг, при помощи которого укладывались связки. Необходимо отметить, что использование фашин и гатей являлось временным средством. Они применялись только для обеспечения штурма, прорыва или иных стремительных действий. При движении больших колонн или использовании относительно длительное время настилы из фашин и гатей приходили в негодность — они либо уходили в грунт, либо крошились и даже переламывались. В послевоенные годы были разработаны металлические плиты, предназначенные для прокладки временных дорог и даже аэродромных полос.
Послевоенная бронированная инженерная машина «Черчилль» оснащена башней в стиле танка «Центурион», на которой смонтированы гранатометы для постановки дымовых помех.
Вверху. Танк «Черчилль» с большой связкой фашин. Такие приспособления использовались при высадке войск союзников на песчаное морское побережье 6 июня 1944 года.
Слева. Танк «Черчилль» со связкой фашин, закрепленных тросом в передней части корпуса, буксирует санки с дополнительными фашинами. Использование троса позволяло очень быстро сбросить связку.
Большая Энциклопедия Нефти и Газа, статья, страница 1
Фашина
Cтраница 1
Фашины однокомель-ные представляют собой пуки хвороста, сложенного комлями в одну сторону, перевязанные двумя, иногда тремя вицами. Вязаные прутяные канаты представляют собой неопределенной длины пуки тонких, гибких ивовых прутьев, сложенных вперевязку и стянутых вицами.
Фашины могут быть прямыми или арочными. [3]
 [5]
[5]Фашины вяжут из хвороста толщиной до 3 см на шаблонах мягкой проволокой диаметром 1 — 3 мм. Перевязки проволокой делают от концов фашины на расстоянии ее диаметра, а последующие — через два диаметра. [7]
Фашинами укрепляют как дно канавы, так и откосы ее, причем в пределах укрепления сечение канавы устраивают прямоугольной формы. Размер этого сечения определяется по расчету. [8]
Торцы фашин всей своей поверхностью должны опираться на грунт. [10]
Для фашин из камыша или тростника отбирают только зрелые растения, удаляют со стеблей листья и метелки. [12]
Длина фашин равна 3 м; для связки фашин применяют проволоку диаметром 1 0 — 1 5 мм. Проводящую дренажную сеть устраивают в виде открытых канав большего размера, чем сборная сеть. Проводящая дренажная сеть в нижней части своего сечения во избежание размыва требует при слабых грунтах и больших скоростях укрепления фашинами. Верхние откосы дренажных канав укрепляются одерновкой.
[13]
Проводящую дренажную сеть устраивают в виде открытых канав большего размера, чем сборная сеть. Проводящая дренажная сеть в нижней части своего сечения во избежание размыва требует при слабых грунтах и больших скоростях укрепления фашинами. Верхние откосы дренажных канав укрепляются одерновкой.
[13]
В вычислительных фашинах математические величины представляются какими-либо физическими величинами, взаимодействие которых отображает взаимодействие математических величин, а результирующая физическая величина — математический результат. [14]
Можно соединять фашины между собой кольями диаметром 3 — 4 см, длиной 60 — 65 см, вбивая их в шахматном порядке в каждую последующую пару фашин. В результате отдельные фашины превращаются в свод, выдерживающий значительные нагрузки. [15]
Страницы: 1 2 3 4
Бомбоубежище, построенное из габионов, крытых дерном опор и фашин — Просмотр — Mировая цифровая библиотека
Режим “Читать” обеспечивает скорость отклика
“Увеличение изображения” позволяет увидеть детали
Для ускорения навигации режим “Сетка” предоставляет отображение сразу многих страниц
Навигация с клавиатурой
| Перейти на следующую страницу | Клавиша Page down (страница вверх), Пробел, j |
|---|---|
| Перейти на предыдущую страницу | Клавиша Page up (страница вниз), Shift+пробел, k |
| Повернуть влево | Alt+стрелка влево |
| Повернуть вправо | Alt+стрелка вправо |
| Перейти на просмотр в виде сетки | g |
| Увеличить изображение на данной странице | z |
| Использовать полноэкранный режим | f |
| Отображение справки | ? |
Сенсорное управление
| Перейти на следующую страницу | Провести по экрану вправо Коснуться правого края экрана |
|---|---|
| Перейти на предыдущую страницу | Провести по экрану влево Коснуться левого края экрана |
| Перейти на просмотр в виде сетки | Коснуться «Сетка» |
| Увеличить изображение на данной странице | Коснуться «Увеличение» |
Фашины — Справочник химика 21
Очистка и мелкий ремонт одерновки, мостовой, фашин, каменных отсыпей и подпорных стен. [c.48]
[c.48]Рекомендуемая длина дрен не более 120 м. Трубы укладывают впритык с зазорами 4—6 мм. Под стык кладут глиняную подушку (рис. 4.89). Место стыка сверху закрывают толем, войлоком, березовой корой, перевернутой дерниной, а иногда засыпают щебенкой или гравием. При отсутствии указанных выше труб дренаж может выполняться из фашин, гравия (щебня) или деревянных труб из досок. [c.375]
Верх затопленных оголовков располагают ниже низа льда (при ледоставе) на 0,3—0,4 м и не допускают их вмерзания в ледяной покров, устраивая при необходимости утепляемые проруби. Трубы, соединяющие оголовки и водозаборные устройства раздельного типа с насосной станцией, укладывают ниже дна реки и при опасности размыва сверху защищают креплением (фашины, тюфяки, мощение и др.). Трубы, как -правило, выполняют из железобетона. Применяют асбестоцементные й стальные трубы, но это должно быть обосновано. [c.279]
Глубину заложения подошвы фундамента увязывают с глубиной возможного размыва русла и принимают при естественных основаниях на 2 м ниже возможного уровня размыва при свайном основании это> заглубление можно уменьшить до 1 м.
 При скальных основаниях убирают верхнюю разрушенную скалу, а при трещиноватости выполняют цементацию. Если грунты плохие, по периметру основания сооружения устраивают замкнутое шпунтовое ограждение. Дно реки у сооружения руслового типа, дно и откосы у сооружения берегового типа должны быть тщательно укреплены. Для крепления используют местные материалы, а также применяют сборные железобетонные плиты, габионы, отсыпку камня, фашины, фашинные тюфяки и др. [c.280]
При скальных основаниях убирают верхнюю разрушенную скалу, а при трещиноватости выполняют цементацию. Если грунты плохие, по периметру основания сооружения устраивают замкнутое шпунтовое ограждение. Дно реки у сооружения руслового типа, дно и откосы у сооружения берегового типа должны быть тщательно укреплены. Для крепления используют местные материалы, а также применяют сборные железобетонные плиты, габионы, отсыпку камня, фашины, фашинные тюфяки и др. [c.280]VI группа — тяжелые суглинистые, сильно оподзоленные делювиальные сносы нижних частей склона с близким к поверхности залеганием грунтовых вод. Грунты этой группы непригодны для полей фильтрации для полей орошения могут быть использованы после устройства дренажа. Наиболее удобен фашинный дренаж или открытые канавы через 30—50 м. Нагрузка— 15—20 м га. [c.195]
Стенки подпорные Дренажные сооружения Одерновка в клетку Мостовая каменная Плетневые клетки с засыпкой или мощением Фашины [c.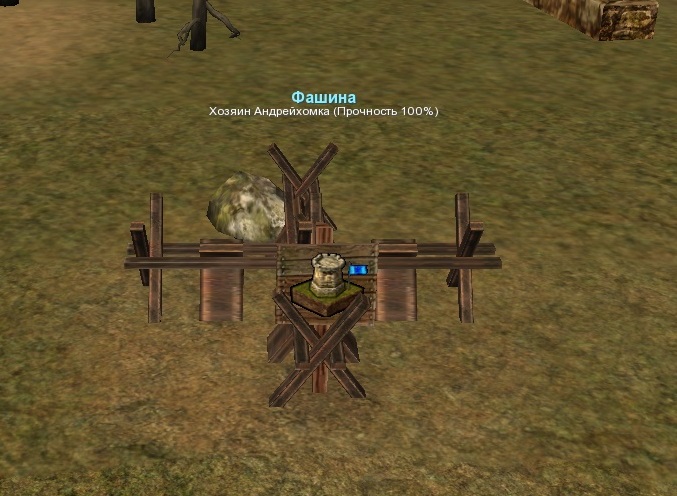 49]
49]
Жерди, фашины (Германия, Англия)…… 0.9 382 [c.472]
Плетневые клетки с засыпкой или мощением Фашины [c.115]
У — водоприемные окна, закрываемые шиберами 2 —сетка сороудерживающая, плоская —всасывающий трубопровод 4 — здание насосной станции 5— лестница б — фашинная выстилка 7 —эжектор 5 — труба эжектора [c.85]
Длина фашин равна 3 м для связки фашин применяют проволоку диаметром 1,0—1,5 мм. Фашины укрепляют вбиваемыми в грунт свайками, диаметр которых изменяется в пределах от 6 до 14 см при соответствующих длинах свай от 1,1 до 2,5 м. Проводящую дренажную сеть устраивают в виде открытых канав большего размера, чем сборная сеть. Глубина этих канав доходит до 4—5 м. Проводящая дренажная сеть в нижней части своего сечения во избежание размыва требует при слабых грунтах и больших скоростях укрепления фашинами. Верхние откосы дренажных канав укрепляются одерновкой. [c.156]
Крепление дренажных канав фашинами также требует постоянного надзора и ежегодной замены части фашин, стоек. [c.164]
[c.164]
В первом по движению жидкости пруде установлены поперечные стенки из фашин или плетня, которые улучшают распределение жидкости и удерживают плавающие вещества. Валики, разделяющие пруды, имеют по верху ширину 1—1,5 м. [c.408]
Открытые осушительные каналы, сборные сети и выпуски устраивают в виде каналов трепецеидальной формы с боковыми стенками 1ЮД углом естественного откоса грунтов. В слабых грунтах стенки каналов следует укреплять фашинами, дерном, а иногда камнем. Расчет этих каналов производят по известным формулам гидравлики. Уклон каналов принимают не менее 0,005. [c.94]
Открытые осушительные канавы или сборную сеть, в которую поступают воды от закрытрго дренажа, устраивают в виде каналов трапецеидальной формы с боковыми сторонами под углом естественного откоса грунта. Слабые грунты необходимо крепить фашинами, дерном, а иногда камнем (рис. 4.90). [c.375]
В Советском Союзе вопрос подпочвенного орошения разрабатывается ВНИИГИМ.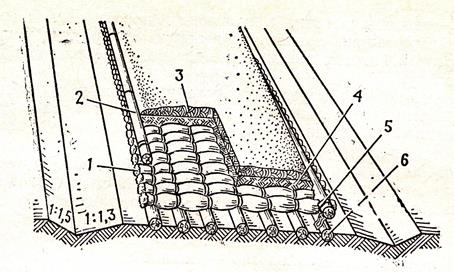 При подпочвенном орошении полив производится отстоенными сточными водами он также осуществляется периодически с поливной нормой 400—600 м /га. При устройстве оросительной сети используются трубы из различных материалов или кротовины, устройство которых возможно на структурных почвах. Поступление воды в грунт осуществляется через стыки, специальные отверстия или щели. Для увлажнителей испольг уются трубы диаметром 50 мм, закладываемые на глубину 0,5 м при расстоянии между ними от 1,4 Л1. Применение пористых труб, шлака, гравия, фашин, камыша и т. п. не молУстройство продольных щелей на трубах увлажнителей следует предпочитать снизу такие увлажнители прн небольших нагрузках (порядка 3500 м 1га в год) могут прослужить до 30—35 лет. Кротовины без щелей выдерживают 13 и более поливов, кротовины со щелями разрушаются довольно быстро. Более надежный эффект дают кротовины, осуществленные с силикатизацией или битумизацией грунта. Напор в увлажнителях принимается не более-40—50 см. Подача поливной нормы производится за 2—3 часа- [c.
При подпочвенном орошении полив производится отстоенными сточными водами он также осуществляется периодически с поливной нормой 400—600 м /га. При устройстве оросительной сети используются трубы из различных материалов или кротовины, устройство которых возможно на структурных почвах. Поступление воды в грунт осуществляется через стыки, специальные отверстия или щели. Для увлажнителей испольг уются трубы диаметром 50 мм, закладываемые на глубину 0,5 м при расстоянии между ними от 1,4 Л1. Применение пористых труб, шлака, гравия, фашин, камыша и т. п. не молУстройство продольных щелей на трубах увлажнителей следует предпочитать снизу такие увлажнители прн небольших нагрузках (порядка 3500 м 1га в год) могут прослужить до 30—35 лет. Кротовины без щелей выдерживают 13 и более поливов, кротовины со щелями разрушаются довольно быстро. Более надежный эффект дают кротовины, осуществленные с силикатизацией или битумизацией грунта. Напор в увлажнителях принимается не более-40—50 см. Подача поливной нормы производится за 2—3 часа- [c. 191]
191]
Многоступенчатые биологическиепруды обычно устраивают на местности, имеющей уклон, и располагают ступенями так, что вода из верхнего пруда направляется в расположенный ниже. В первом по движению жидкости пруде устанавливают поперечные стенки из фашин или плетня, которые улучшают распределение жидкости и удерживают плавающие вещества. В последнем пруду сточные воды содержат растворенный кислород, поэтому в нем возможно разведение рыбы. Из него вода выпускается с помощью шахтных водосбросов. [c.152]
Наличие в русле долго не замерзающих участков (полыней н майн) приводит к переохлаждению потока воды, а впоследствии к образованию щугн и донного льда. Для предотвращения этого явления в начале зимы необходимо искусственно замораживать полыни, устраивая плавающую рещетку из досок, жердей или. фашин. [c.78]
Сборная закрытая дренажная сеть на полях орошения и полях фильтрации состоит из глазурованных каменно-керамических труб диаметром от 150 мм и выше. Глубина дренажных канав определяется условиями почвы и принимается минимум в 1,5 м. Боковые откосы канав обычно полуторные, а при сдабых грунтах — двойные в последнем случае дренажные сборные канавы в части, проводящей воду, приходится укреплять фашинами из ивняка для предохранения их от размыва. [c.156]
Глубина дренажных канав определяется условиями почвы и принимается минимум в 1,5 м. Боковые откосы канав обычно полуторные, а при сдабых грунтах — двойные в последнем случае дренажные сборные канавы в части, проводящей воду, приходится укреплять фашинами из ивняка для предохранения их от размыва. [c.156]
Ширина канав по дну принимается в этом случае кратной нормальному диаметру фашины нежелательно ширину канав принимать менее 0,3—0,4 м. Фашинами укрепляют как дно канавы, так и откосы ее, причем в пределах укреплешия сечение канавы устраивают прямоугольной формы. Размер этого сечения определяется по расчету. [c.156]
Спасут земля и хворост | Еженедельник «Военно-промышленный курьер»
История военного дела и военной техники в значительной мере определяется непрекращающимся соперничеством средств защиты и средств нападения или, говоря образно, щита и меча. Она также дает немало примеров, когда идея, которая, казалось бы, отошла в прошлое, возрождалась на новом техническом и технологическом уровне.
История военного дела и военной техники в значительной мере определяется непрекращающимся соперничеством средств защиты и средств нападения или, говоря образно, щита и меча. Она также дает немало примеров, когда идея, которая, казалось бы, отошла в прошлое, возрождалась на новом техническом и технологическом уровне.
Туры, габионы, фашины
Ярким примером того может служить развитие защитных приспособлений на основе емкостей, заполненных грунтом (землей, песком, камнями). Их широкое распространение начинается на рубеже XV–XVI веков, когда развитие в странах Европы артиллерии и особенно распространение литых чугунных ядер привели к коренным изменениям в долговременной и полевой фортификации.
Войска, осаждавшие крепость, чтобы защититься от артиллерийского огня оборонявшихся, были вынуждены насыпать вокруг своего лагеря и батарей валы, копать траншеи. Одним из простых и эффективных приспособлений для решения фортификационных задач в этих условиях стали круглые бездонные корзины, сплетенные из прутьев, которые устанавливались на позициях и наполнялись землей.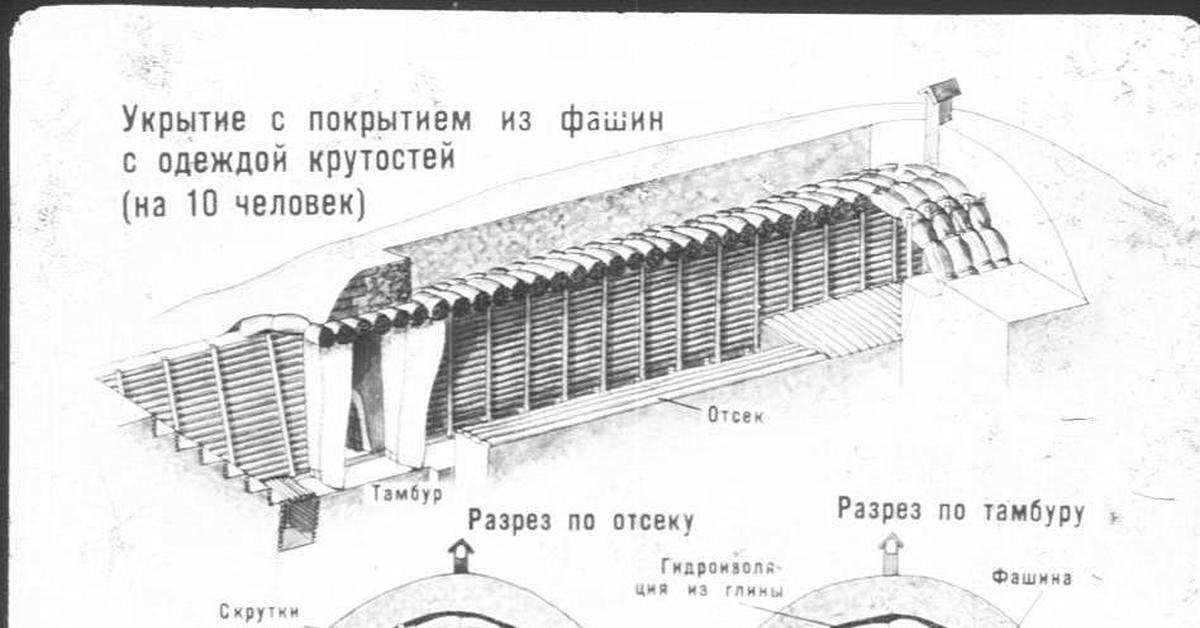 В России за ними закрепилось наименование туры (от французского tour – башня), но в странах Западной Европы их чаще называли габионами (от итальянского gabbione – клетка). Установить и «насыпать» туры можно было гораздо быстрее, чем построить собственно земляное укрепление. К тому же тур, выбитый неприятельским ядром, легко заменялся новым. Более того, саперы использовали тур как подвижное прикрытие: положив горизонтально и наполнив вместо земли хворостом или шерстью, его катили впереди с помощью специальных крюков.
В России за ними закрепилось наименование туры (от французского tour – башня), но в странах Западной Европы их чаще называли габионами (от итальянского gabbione – клетка). Установить и «насыпать» туры можно было гораздо быстрее, чем построить собственно земляное укрепление. К тому же тур, выбитый неприятельским ядром, легко заменялся новым. Более того, саперы использовали тур как подвижное прикрытие: положив горизонтально и наполнив вместо земли хворостом или шерстью, его катили впереди с помощью специальных крюков.
Кроме туров, активно применялись наполненные землей мешки и фашины. Мешки с землей или песком в качестве строительного материала появились в глубокой древности. Так, персы еще в IV–V веках возводили из них в пустынной местности целые укрепления. Не менее давнюю историю имели связки хвороста – фашины, которые еще в период Античности и в Средние века активно использовались для заполнения крепостных рвов. С развитием артиллерии фашины стали применяться в укреплениях из туров и для прикрытия траншей.
В XVII–XVIII веках произошел настоящий расцвет фортификации с применением туров, фашин и земленосных мешков. Большое значение укреплениям такого рода придавал, например, выдающийся французский фортификатор и инженер Себастьян Вобан (1633–1707). В русском переводе 1744 года одного из его трактатов говорится: «С начала осады надобно туры в запасе иметь и смотреть, чтобы они из мяхкого хвороста и хорошо зделаны были». Для изготовления туров Вобан советовал оплетать хворостом восемь, девять или десять кольев «округлостью в четыре или в пять дюймов», заостренных с одной стороны. Он также указывал, что высота тура должна составлять 2,5 фута (около 0,8 метра) и быть равна диаметру, «чтоб их легче ворочать». Перед началом строительства траншей, как отмечено в трактате, каждый батальон пехоты должен был запасти от двух до трех тысяч (!) туров. Их изготовление рекомендовалось поручать «разумеющим копателям (саперам. – Прим. авт.) и минерам». Эти туры использовались для прикрытия саппы, под которой Вобан понимал переднюю часть траншеи, и устанавливались в ряд «обвостренными колышками» вверх и насыпались землей, причем копатель работал, пригнувшись за турами. Засыпанную землю надо было «поколачивать» лопатой или специальной колотушкой (чекмарем), «чтобы земля в нем оседала». Между турами располагались поставленные друг на друга мешки с землей, сверху укладывались фашины, которые полагалось надевать на острые концы колышков, после чего сверху насыпалась земля. Из туров и фашин Вобан рекомендовал возводить и более сложные сооружения, например кавалиеры, для чего три ряда туров ставились друг на друга.
Засыпанную землю надо было «поколачивать» лопатой или специальной колотушкой (чекмарем), «чтобы земля в нем оседала». Между турами располагались поставленные друг на друга мешки с землей, сверху укладывались фашины, которые полагалось надевать на острые концы колышков, после чего сверху насыпалась земля. Из туров и фашин Вобан рекомендовал возводить и более сложные сооружения, например кавалиеры, для чего три ряда туров ставились друг на друга.
В России первые «переложения» книг Вобана появились после 1720 года. Однако несколько раньше по приказу Петра I, придававшего большое значение фортификации и инженерному делу, были переведены и опубликованы труды еще нескольких европейских военных инженеров. Во многих из них турам и фашинам уделялось большое внимание. Так, в книге немецкого артиллериста Иоанна Зигмунта Бухнера, опубликованной в России в 1711 году, турам была посвящена отдельная глава. В ней рекомендовалось использовать для прикрытия орудий туры трех видов: двойные (высота – девять-десять футов), «одинакие» (семь-восемь) и половинчатые (высота – шесть футов при диаметре всего в четыре фута). Рекомендации Вобана, Бухнера и других инженеров отнюдь не носили умозрительного характера. Армия Петра I действительно активно использовала для защиты своих позиций туры, фашины и мешки с песком, которые постоянно упоминаются в распоряжениях императора.
Рекомендации Вобана, Бухнера и других инженеров отнюдь не носили умозрительного характера. Армия Петра I действительно активно использовала для защиты своих позиций туры, фашины и мешки с песком, которые постоянно упоминаются в распоряжениях императора.
Все эти приспособления сохраняли свое значение на протяжении XVIII и большей части XIX века. Очень широкое применение нашли они во время Крымской войны. По подсчетам видного историка фортификации Цезаря Кюи (1835–1918), англичане и французы при осаде Севастополя употребили до двух миллионов мешков с землей и песком. Защитники города активно использовали те же мешки, туры, наполненные землей бочки. Имело место и своеобразное новшество: влившиеся в состав севастопольского гарнизона моряки Черноморского флота плели корзины для земли и щиты для прикрытия амбразур из корабельных канатов. В опубликованном в конце XIX века учебнике по полевой фортификации Цезаря Кюи турам, фашинам, земленосным мешкам был посвящен особый раздел. Туры в нем разделены на два типа: сапные и батарейные, которые различались размерами. Автор привел также своеобразную «норму выработки». По его мнению, три человека за 12 часов могли изготовить из готового хвороста 8–12 сапных туров или шесть-семь бастионных. Фашины в учебнике также подразделялись на несколько типов: батарейные или обыкновенные, предназначенные для одежды крутостей, потолочные – для покрытия потолков блиндированных строений, водяные, внутрь которых «ввязаны» камни для лучшего погружения в воду, и другие. Особенно высокую оценку дал Кюи земляным (земленосным) мешкам. «Мешки, – писал он, – бесспорно, один из лучших материалов и употребление их всегда имело обширнейшее развитие». Кюи подробно рассмотрел использование мешков для одежды крутостей и щек амбразур, сооружения брустверов, описал, как «на скате бруствера из земляных мешков выделываются бойницы, прикрывающие стрелков от ружейного огня».
Автор привел также своеобразную «норму выработки». По его мнению, три человека за 12 часов могли изготовить из готового хвороста 8–12 сапных туров или шесть-семь бастионных. Фашины в учебнике также подразделялись на несколько типов: батарейные или обыкновенные, предназначенные для одежды крутостей, потолочные – для покрытия потолков блиндированных строений, водяные, внутрь которых «ввязаны» камни для лучшего погружения в воду, и другие. Особенно высокую оценку дал Кюи земляным (земленосным) мешкам. «Мешки, – писал он, – бесспорно, один из лучших материалов и употребление их всегда имело обширнейшее развитие». Кюи подробно рассмотрел использование мешков для одежды крутостей и щек амбразур, сооружения брустверов, описал, как «на скате бруствера из земляных мешков выделываются бойницы, прикрывающие стрелков от ружейного огня».
Современное применение
В войнах начала ХХ века туры и фашины продолжали использоваться для возведения оборонительных сооружений, но почти всегда в сочетании с другими материалами, поскольку укрепление, составленное из одних корзин с землей или вязанок хвороста, сопротивляться огню современной артиллерии не могло. Наиболее употребительными оставались, пожалуй, мешки. В пособии по полевой фортификации 1917 года о них говорилось: «Земленосные мешки применяются не только для одежд, но и для переноски земли, для быстрого устройства бруствера; они же могут заменять щиты (броневые. – Прим. авт.) или забрасывают проволочные заграждения и быстро исправляют повреждения окопов; из них делают бойницы и другие детали окопов, словом, применение земленосных мешков крайне разнообразно и полезно как по быстроте работы, так и по прочности и легкости исправления».
Наиболее употребительными оставались, пожалуй, мешки. В пособии по полевой фортификации 1917 года о них говорилось: «Земленосные мешки применяются не только для одежд, но и для переноски земли, для быстрого устройства бруствера; они же могут заменять щиты (броневые. – Прим. авт.) или забрасывают проволочные заграждения и быстро исправляют повреждения окопов; из них делают бойницы и другие детали окопов, словом, применение земленосных мешков крайне разнообразно и полезно как по быстроте работы, так и по прочности и легкости исправления».
Эта высокая оценка земленосных мешков полностью оправдалась в ходе Второй мировой войны и военных конфликтов второй половины ХХ века. На фотографиях советских городов и позиций армии времен Великой Отечественной войны можно постоянно видеть укрепления и защитные сооружения, возведенные с помощью этого нехитрого «строительного материала». В сочетании с другими материалами (в том числе металлическими конструкциями) мешки с грунтом применялись и позже. Используются они по сей день, правда, не холщовые, а бумажные.
Используются они по сей день, правда, не холщовые, а бумажные.
Между тем, как это бывает очень часто, идеи военных инженеров подхватили и развили гражданские строители. В конце XIX века для укрепления насыпей, защиты берегов рек от подмыва они стали активно применять ящики из металлической проволоки, наполненные щебнем и камнями, которые по аналогии с приспособлениями из прутьев получили наименование габионов. Здесь стоит заметить, что европейские армии в первой половине XIX века наряду с цилиндрическими турами использовали плетенные прямоугольные коробы.
В наши дни многовековая идея тура-габиона вновь оказалась востребована, будучи реализована, разумеется, на совершенно ином, современном технологическом уровне. Доказательством тому служит успех британских габионов системы Hesco Bastion (и одноименной фирмы), разработанных в конце 1980 года Джеймсом Хесселденом. Они представляют собой короб из металлической сети, внутрь которого помещается тканевый контейнер, что позволяет использовать в качестве наполнителя не только камни, но любой материал, независимо от фракции. Габионы Hesco Bastion применялись войсками НАТО для строительства защитных сооружений в Югославии, Афганистане, Ираке.
Новаторский характер носит быстровозводимое полевое укрепление в виде габионов насыпного типа «Редут», разработанное в России. Данное укрепление представляет собой сборную быстровозводимую конструкцию в виде контейнеров из тканевых (либо искусственных) материалов, армированных сварной оцинкованной (или с полимерным порошковым напылением) металлической сетью. «Редут» предназначен для оперативного развертывания временных быстровозводимых укреплений в районах чрезвычайных ситуаций природного и техногенного характера, для защиты от наводнений, возведения дамб, искусственных барьеров, предотвращающих распространение воды и огня (в том числе при лесных пожарах), возведения временных полевых укрытий (укреплений), используемых как в мирное, так и в военное время (оборудование периметра полевых лагерей, обустройство КПП, блокпостов, наблюдательных вышек), в том числе при проведении антитеррористических мероприятий, для укрепления насыпей, автомобильных и железных дорог, речного и морского берегоукрепления, ландшафтных работ, стабилизации почвенной эрозии и консервации грунта. К месту развертывания «Редут» может доставляться любым видом транспорта, включая воздушный. Развертывание по заданной схеме шестисекционного укрепления занимает всего пять – десять минут в зависимости от рельефа местности, а также от численности и подготовленности личного состава. Развернутое укрепление может быть заполнено любым видом грунта (песок, земля, камни), изымаемого непосредственно на месте монтажа.
Испытания габионов «Редут» проводились в 2011 году. Укрепления из габионов возводятся в прямом смысле слова за считаные минуты. Их конструкции удобны и надежны в эксплуатации и позволяют возводить различные фортификационные укрепления на позициях войск, в первую очередь в особых условиях: на местности с высоким уровнем грунтовых вод, в горных, пустынно-степных районах и зимой. Защитное оцинкованное покрытие стального каркаса габионов, а также применение прочного синтетического материала для оболочки обеспечивают условия для длительной эксплуатации взведенных защитных стен или возможность длительного хранения изделий на складах, в закрытых помещениях. Испытания габионов показали также высокую прочность, надежность и обеспеченность защиты по непробиваемости их пулями (7,62-мм со 100 метров), осколками мин и гранат.
отзывы, фото и характеристики на Aredi.ru
Мы доставляем посылки в г. Калининград и отправляем по всей России
- 1
Товар доставляется от продавца до нашего склада в Польше. Трекинг-номер не предоставляется.
- 2
После того как товар пришел к нам на склад, мы организовываем доставку в г. Калининград.
- 3
Заказ отправляется курьерской службой EMS или Почтой России. Уведомление с трек-номером вы получите по смс и на электронный адрес.
!
Ориентировочную стоимость доставки по России менеджер выставит после оформления заказа.
Гарантии и возврат
Гарантии
Мы работаем по договору оферты, который является юридической гарантией того, что мы выполним
свои обязательства.
Возврат товара
Если товар не подошел вам, или не соответсвует описанию, вы можете вернуть его, оплатив
стоимость обратной пересылки.
- У вас остаются все квитанции об оплате, которые являются подтверждением заключения сделки.
- Мы выкупаем товар только с проверенных сайтов и у проверенных продавцов, которые полностью отвечают за доставку товара.
- Мы даем реальные трекинг-номера пересылки товара по России и предоставляем все необходимые документы по запросу.
- 5 лет успешной работы и тысячи довольных клиентов.
| Функциональный ключ | Позиция (я) | Описание Действия | Графическое представление | Длина |
|---|---|---|---|---|
В этом подразделе раздела «Патология и биотехнология» описывается эффект экспериментальной мутации. одной или нескольких аминокислот на биологические свойства белка. Мутагенез i | 22 | K → E: снижение связывания и потери актина активности связывания актина; когда связан с Е-43 и Е-398. Снижение связывания актина и потеря активности связывания актина; когда связан с Е-43; Е-100 и Е-109. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 29 | F → A: Сильно снижает активность связывания актина. Ручное утверждение на основе эксперимента в i
| 1 | |
| Мутагенез i | 36 — 39 | SASS → AAAA: устраняет коллапс конуса роста аксона в ответ на NGF. Ручное утверждение, основанное на эксперименте в i | 4 | |
| Мутагенез i | 39 | S → A: потеря фосфорилирования. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 39 | S → D: фосфомиметический мутант, который сильно снижает активность связывания актина. Ручное утверждение на основе эксперимента в i
| 1 | |
| Мутагенез i | 43 | K → E: Снижение связывания актина и потеря активности связывания актина; когда связан с E-22 и E-398. Снижение связывания актина и потеря активности связывания актина; когда связан с E-22; Е-100 и Е-109. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 49 | E → A: Сильно снижает активность связывания актина. Ручное утверждение на основе эксперимента в i
| 1 | |
| Мутагенез i | 100 | R → E: умеренно сниженная активность связывания актина и связывания актина; когда связан с E-109 и E-247. Снижение связывания актина и потеря активности связывания актина; когда связан с E-22; Е-43 и Е-109. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 109 | R → E: умеренно сниженная активность связывания актина и связывания актина; когда связан с E-100 и E-247. Снижение связывания актина и потеря активности связывания актина; когда связан с E-22; Е-43 и Е-100. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 149 — 151 | RKR → AAA: сильно снижает активность связывания актина. Ручное утверждение на основе эксперимента в i
| 3 | |
| Мутагенез i | 150 — 151 | KR → EE: Не оказывает значительного влияния на активность связывания актина и связывания актина; когда связан с E-313. Ручное утверждение, основанное на эксперименте в i | 2 | |
| Мутагенез i | 247 — 250 | KVGK → AVGA: снижает активность связывания актина. Ручное утверждение на основе эксперимента в i
| 4 | |
| Мутагенез i | 247 | K → E: умеренно сниженная активность связывания актина и связывания актина; когда связан с Е-100 и Е-109. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 271 | R → E: Снижение актин-связывающей активности и активности связывания актина; когда связан с E-353 и E-358. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 313 | K → E: Нет значительного влияния на актин-связывающую и актин-связывающую активность; когда связан с 150-E-E-151. Ручное утверждение, основанное на эксперименте i | 1 | |
| Мутагенез i | 341 | R → E: Нет значительного влияния на актин-связывающую активность и активность связывания актина; когда связан с E-348 и Q-464. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 348 | R → E: Нет значительного влияния на актин-связывающую и актин-связывающую активность; когда связан с E-341 и Q-464. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 353 | K → E: Снижение активности связывания актина и связывания актина; когда связан с E-271 и E-358. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 358 | K → A: Сильно снижает активность связывания актина. Ручное утверждение на основе эксперимента в i
| 1 | |
| Мутагенез i | 358 | K → E: Снижение активности связывания актина и связывания актина; когда связан с E-271 и E-353. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 392 | H → A: Снижение активности связывания актина. Ручное утверждение, основанное на эксперименте i | 1 | |
| Мутагенез i | 398 | R → E: Снижение связывания актина и потеря активности связывания актина; когда связан с Е-22 и Е-43. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 464 | K → Q: Нет значительного влияния на актин-связывающую и актин-связывающую активность; когда связан с E-341 и E-348. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 471 | K → A: Снижение активности связывания актина. Ручное утверждение, основанное на эксперименте в i | 1 | |
| Мутагенез i | 488 | A → W: Снижение активности связывания актина. Ручное утверждение на основе эксперимента в i | 1 |
Изучение роли фасцина-1 в подоцитах, подвергнутых механическому стрессу
Культура клеток
Условно иммортализованные подоциты (SVI; CLS Cell Line Service GmbH, Eppelheim , Германия) обрабатывались, как описано ранее 6 .
Эксперименты на мышах
Для выделения почек, клубочков и первичных подоцитов мышей (C57BL / 6) анестезировали и умерщвляли. Все процедуры с животными выполнялись в соответствии с национальными директивами по защите животных, которые соответствуют Руководству Национального института здравоохранения по уходу и использованию лабораторных животных и были одобрены местными государственными органами (LALFF (Landesamt für Landwirtschaft, Lebensmittelsicherheit und Fischerei Мекленбург-Передняя Померания)).Клубочки и первичные подоциты выделяли методом просеивания, описанным ранее 6 .
Эксперименты по механическому напряжению
Эксперименты по механическому напряжению проводились в соответствии с нашим предыдущим исследованием 6 . Дифференцированные подоциты культивировали в течение 3 дней в шестилуночных планшетах с гибким силиконовым дном (Bioflex, Flexcell ® International Corporation, Берлингтон, Северная Каролина, США). Планшеты устанавливали на коллектор, соединенный с устройством для растягивания (CLS Cell Line Service GmbH).Частота цикла составляла 0,5 Гц, а максимальная линейная деформация 5%. Количество прикрепившихся клеток определяли путем подсчета окрашенных подоцитов в 40 микроскопических полях.
Экстракция РНК, синтез кДНК и qRT-PCR
Образцы клеток / тканей обрабатывали в Tri-Reagent (Sigma-Aldrich, Сент-Луис, Миссури, США) в соответствии с инструкциями производителя. Для синтеза кДНК 1 мкг выделенной тотальной РНК транскрибировали с использованием набора для обратной транскрипции QuantiTect (Qiagen, Hilden, Германия). Количественный анализ ПЦР в реальном времени (qRT-PCR) выполняли на LightCycler Nano (Roche Diagnostics GmbH, Мангейм, Германия) с использованием iTaq Universal SYBR Green Supermix (Bio-Rad) в присутствии специфических праймеров для Fscn1 (смысл : 5′-AACCCCTTGCCTTTCAAACT-3 ‘; антисмысловой: 5′-CAGAGTTCCCCATGGAAAGA-3’), Gapdh (смысл: 5′-ACCCAGAAGACTGTGGATGG-3 ‘; антисмысловой: 5′-CACATTGGAC325-смысловой: : 5’-AGTTCATCAGGCACCAGTCAG-3 ‘; антисмысловой: 5′-ATCAGGATCTGGCCCTTGAAC-3’).Относительное выражение рассчитывали путем нормализации значений к Gapdh или Rpl32 .
Вестерн-блот
Клетки трипсинизировали, дважды промывали в PBS и растворяли в буфере для лизиса, содержащем 50 мМ октилглюкозид, 50 мМ Трис, 150 мМ NaCl, 10 мМ CaCl 2 , 1 мМ MgCl 2 и 1,5 мг / мл полный ингибитор протеазы (Roche Diagnostics). Белковые экстракты подвергали Вестерн-блоттингу или выделению фосфопептидов с использованием набора Pierce ™ Phosphoprotein Enrichment Kit (Thermo Fisher Scientific).После добавления буфера для образцов SDS-PAGE (конечные концентрации: 32 мМ Трис-HCl, 1% SDS, 5% глицерин, 0,05% бромфенолового синего, 3,25% 2-меркаптоэтанола, pH 6,8) лизаты клеток нагревали при 95 ° C. , 5 мин. Аликвоты лизата, содержащие 2 мкг фосфопротеинов и 20 мкг общих белков, разделяли с использованием 4-20% геля Mini-PROTEAN ® TGX ™ (Bio-Rad Laboratories) и переносили на нитроцеллюлозную мембрану. Мембраны погружали на ночь в блокирующий буфер (10 мМ Трис, 100 мМ NaCl, 5% обезжиренное сухое молоко, 0.2% Tween-20, pH 7,5) и инкубировали в течение 2 ч при комнатной температуре в TBS-Tween (0,2%) со следующими антителами: анти-фасцин-1 (sc-21743, Santa Cruz), анти-фасцин-1 Ser. -39-фосфо-специфическое антитело (FP2661; ECM Biosciences, Версаль, Кентукки, США) и анти-Gapdh (sc-25778, Санта-Крус). Блоты инкубировали в течение 1 ч с конъюгированным с HRP вторичным антителом мыши против — (sc-2031, Santa Cruz) или кроликом против — (sc-2030, Santa Cruz) и проявляли с использованием хемилюминесцентного субстрата SuperSignal ™ West Pico (Thermo Fisher Scientific) и, наконец, экспонировались на рентгеновских пленках (Fujifilm Super RX, FUJIFILM, Токио, Япония).В некоторых случаях обнаружение связанных антител проводили с помощью вторичных антител, меченных щелочной фосфатазой (антимышиные AP, Acris Antibodies GmbH, Херфорд, Германия) и набора субстратов для конъюгатов фосфатаз (Bio-Rad Laboratories). Для относительной количественной оценки проявленные рентгеновские пленки сканировали и анализировали с помощью ImageJ (версия 1.48 v, NIH, Bethesda, MD, USA) 32 . Определяли средние значения серого для конкретных сигналов fasin-1 и нормировали на средние значения серого для сигналов Gapdh.
2-D гель-электрофорез
Растянутые и соответственно нерастянутые клетки собирали и белки экстрагировали в буфере для лизиса, содержащем 8 М мочевину и 2 М тиомочевину.Содержание белка определяли по методу Брэдфорда 33 . 2-DE выполняли, как описано 34 . Вкратце, 125 мкл белкового раствора (содержащего 40 мкг белка) суспендировали в среде для регидратации, состоящей из 8 М мочевины, 2 М тиомочевины, 2% (мас. / Об.) CHAPS, 0,5% (об. / Об.) Буфера IPG pH 3-10, и несколько зерен бромфенолового синего в конечном объеме 350 мкл. Образцы наносили на полоски геля IEF с нелинейным градиентом pH 3–10 7 см для изоэлектрической фокусировки (прибор IPGphor, GE Healthcare, Little Chalfont, UK).Полоски геля IEF оставляли на 1 мин при 200 В. Затем прикладывали 3500 В на 2,5 часа. Полоски геля уравновешивали в течение 15 минут каждую в уравновешивающем буфере SDS, состоящем из 50 мМ трис-HCl, pH 8,8, 6 М мочевины, 30% (об. / Об.) Глицерина, 2% (мас. / Об.) SDS, нескольких зерен бромфенолового синего и 1% (мас. / об.) дитиотреитола или 2,5% (мас. / об.) йодацетамида, соответственно. Разделение по второму измерению проводили с использованием 12,5% полиакриламидных гелей в присутствии 0,1% (мас. / Об.) Додецилсульфата натрия. Гели работали при 20 мА в течение 10 мин и 40 мА в течение примерно 1 мин.5 ч в аппарате для вертикального электрофореза (Bio-Rad Laboratories, Геркулес, Калифорния, США). После блоттинга мембраны погружали на 1 час в блокирующий буфер (10 мМ Трис, 100 мМ NaCl, 5% обезжиренное сухое молоко, 0,2% Твин-20, pH 7,5) и инкубировали в течение 2 часов при комнатной температуре в TBS-Tween. (0,2%) с антителом против фасцина-1 (1: 500; sc-21743, Santa Cruz Biotechnology, Санта-Крус, Калифорния, США). Блоты инкубировали в течение 1 ч с мышиным вторичным антителом против — , конъюгированным с пероксидазой хрена (1: 5000; # 7076, Cell Signaling Technology, Кембридж, Великобритания), и проявляли с использованием хемилюминесцентного субстрата SuperSignal ™ West Pico (Thermo Fisher Scientific, Waltham, Массачусетс, США) и, наконец, экспонировали с помощью системы ChemiDoc ™ MP (Bio-Rad Laboratories).Анализ белков выполняли с помощью программного обеспечения для протеома Delta2D (Decodon, Greifswald, Германия).
Жидкостная хроматография-масс-спектрометрия (ЖХ-МС)
3 мкг белкового экстракта растянутых и нерастянутых клеток восстанавливали в 20 мМ бикарбонате аммония с помощью 2,5 мМ дитиотреитола (DTT) в течение 1 ч при 60 ° C и 10 мМ йодуксусной кислоты ( IAA) в течение 30 мин при 37 ° C. Впоследствии пробы переваривали трипсином в течение ночи при 37 ° C. Данные МС получали на квадрупольном масс-спектрометре Orbitrap Velos с линейной ловушкой (Thermo Fisher Scientific), оборудованном источником ионов наноэлектроспрея.Полученные данные анализировали с помощью программного обеспечения Proteome Discoverer 2.0 (Thermo Fisher Scientific). Поисковые машины SEQUEST-HT и MASCOT использовались для идентификации пептидов / белков. При поиске в базе данных использовалась база данных Uniprot Swiss-Prot (версия: октябрь 2015 г.).
Трансфекция плазмид и миРНК
Для трансфекции плазмид мы использовали pEGFP-fasin-1-S39A (нефосфорилируемый мутант) и pEGFP-fasin-1-S39D (фосфомиметический мутант), любезно предоставленные доктором Дж. Адамсом (Cleveland Clinic Foundation). , Кливленд, Огайо, США).Клетки культивировали на эластичных мембранах в течение 3 дней и трансфицировали соответствующей плазмидой eGFP, используя jetPEI ® (Polyplus-transfection, Illkirch, France). Нокдаун фасцина-1 был достигнут с использованием миРНК Silencer ® Select (Ambion ® , Thermo Fisher Scientific). Для трансфекции миРНК фасцина-1 (конечная концентрация 30 нМ) мы использовали систему трансфекции K2 ® (Biontex Laboratories GmbH, Мюнхен, Германия). Клетки растягивали через 12–24 ч после трансфекции.Эффективность трансфекции проверяли с помощью вестерн-блоттинга и иммунофлуоресцентного окрашивания на фасцин-1.
Анализ переключения кальция
Для тестов переключения кальция конфлюэнтные подоциты быстро промывали PBS и подвергали EGTA (2 мМ в PBS) при 38 ° C. Через 30 мин клетки переводили в культуральную среду (RPMI 1640, Lonza, Базель, Швейцария) и фиксировали ледяной смесью ацетон / метанол (50/50) в указанные сроки восстановления. Для экспериментов по растяжению клетки трансфицировали плазмидами, кодирующими S39A-, S39D- или фасцин-1 дикого типа, за 48 часов до обработки EGTA.После перехода на RPMI 1640 было приложено механическое напряжение 7% линейной деформации. Клетки фиксировали через 0, 15, 60 и 90 мин после растяжения и визуализировали с помощью GFP-флуоресценции клеток, трансфицированных S39A-, S39D- или диким типом-fascin-1, и путем иммуноокрашивания кроличьими антителами против актина (sc-1616, Santa Cruz Biotechnology. ).
Иммуноцитохимия
Для визуализации филоподий клетки, трансфицированные GFP, фиксировали смесью ацетон / метанол (50/50) в течение 20 мин при -20 ° C, промывали и обрабатывали блокирующим раствором (PBS, 2% фетальной бычьей сыворотки, 2% бычьей сыворотки). сывороточная фракция V, 0.2% рыбий желатин) в течение 1 ч при комнатной температуре. Первичные антитела инкубировали 90 мин при комнатной температуре. Были использованы следующие антитела: мышиный анти-фасцин-1 (sc-21743, Santa Cruz Biotechnology) и кроличий или козий анти-актин (sc-1616, Santa Cruz Biotechnology). После стадии промывки PBS (3 × 5 мин) клетки инкубировали со вторичными антителами в течение 60 мин при комнатной температуре. Связанные антитела визуализировали с помощью вторичных антител, конъюгированных с Cy2 или Cy3 (Jackson ImmunoResearch Laboratories, West Grove, США).Для окрашивания ядер использовали DAPI (Sigma-Aldrich, 1: 150) в течение 5 мин. Все образцы были установлены в Mowiol (Carl Roth, Карлсруэ, Германия) и использованы для лазерной сканирующей микроскопии (LSM) и микроскопии со структурированным освещением (SIM). Количественная оценка флуоресценции актина и фасцина-1 была достигнута путем измерения интенсивности флуоресценции 5 стрессовых волокон 15 репрезентативных растянутых клеток от центра, богатого актином (ARC), до периферии клетки (SigmaScanPro, Systat Software GmbH., Эркрат, Германия ).Для количественной оценки размера и количества фокальных спаек мы разработали специальное программное обеспечение «Инструмент сегментации и анализа фокальных контактов». Фокальные контакты (FC) сегментируются градиентным методом локальных порогов. Специфичность результатов сегментации дополнительно повышается за счет соотнесения периферической области каждого FC с его центральной интенсивностью. Слабосвязанные FC разделены. Наконец, вычисляются конкретные параметры формы и флуоресцентная активность каждого FC. Кроме того, ячейки сегментируются полуавтоматическим методом, и поэтому известно точное положение каждой FC в ячейке.
Гистология
Для парафиновых срезов почек мыши и биоптатов человека образцы обезвоживали и заливали в парафин стандартными процедурами. Парафиновые срезы (5 мкм) вырезали на Leica SM 2000R (Leica Microsystems, Вецлар, Германия). После регидратации срезы демаскировали в цитратном буфере (0,1 М, pH 6,0) путем нагревания в течение 5 минут в скороварке. Срезы окрашивали 1 мг / 100 мл Hoechst 33342 (Sigma-Aldrich) в течение 30 мин. Для иммунофлуоресцентного двойного окрашивания образцы инкубировали с антителом против нефрина (морская свинка; Progen Biotechnik GmbH, Гейдельберг, Германия) и фасцина-1 (HPA005723, Sigma-Aldrich) в течение ночи.Для окрашивания фосфо-фасцином-1 мы использовали мышиное антитело против фосфо-фасцина-1 Ser-39-фосфо-специфические (FM3151; ECM Biosciences). Образцы промывали 1x PBS в течение 3 × 5 мин и инкубировали с Cy3- и Cy2-конъюгированными вторичными антителами против мыши / кролика (Jackson ImmunoResearch Laboratories) в течение 1 часа. После дополнительной промывки образцы помещали в Mowiol (Carl Roth) для флуоресцентной микроскопии.
Гистология биопсий почек человека
Биопсии почек были получены из отделения нефропатологии Института патологии университетской больницы Эрлангена, Германия.Использование материала биопсии остатка почки было одобрено Комитетом по этике Университета Фридриха-Александра в Эрлангене-Нюрнберге, отказавшись от необходимости ретроспективного согласия на использование материала из архива остатка.
Микроматрицы биоптатов почек человека
Биопсии почек человека были собраны в рамках многоцентрового исследования (European Renal cDNA Bank-Kroener-Fresenius Biopsy Bank, ERCB 35 ; для участвующих центров) и были получены от пациентов после информированного согласия и с одобрения местных комитетов по этике.После биопсии почек ткань переносили на ингибитор РНКазы и подвергали микродиссекции на фрагменты клубочков и канальцев. Выделение полной РНК из микродиссектированных клубочков, обратная транскрипция и ОТ-ПЦР в реальном времени были выполнены, как сообщалось ранее 36 . Были использованы предварительно разработанные реагенты TaqMan для человеческого FSCN1 (NM_003088.2), а также эталонные гены, 18 S рРНК и GAPDH (Applied Biosystems). Экспрессию гена-кандидата нормализовали по эталонным генам. Экспрессию мРНК анализировали количественной оценкой стандартной кривой.
Электронная микроскопия
Иммуноэлектронная микроскопия выполнялась на срезах тканей почек размером 90 нм, фиксированных 2,5% параформальдегидом в PBS и залитых в LR White (Sigma Aldrich) в соответствии с протоколом производителя. После блокирования в нормальной козьей сыворотке (Dianova) в PBST 1/30 и 0,1% BSA в течение 75 минут моноклональные антитела фасцина-1 (sc-21743, Santa Cruz Biotechnology) применяли в течение ночи при 4 ° C. После пяти промывок в PBST образцы инкубировали 1 час со вторичным антителом, конъюгированным с частицами золота диаметром 20 нм (BBInternational, Кардифф, Великобритания).После пяти промывок в PBST для удаления несвязанных антител было применено усиление серебра (Nanoprobes; Stony Brooks, Нью-Йорк, США) (5–15 мин), а затем дистиллированная вода (4x). Электронные микрофотографии получали с помощью электронного микроскопа (JEOL JEM 1011, Jeol, Peabody, MA, USA).
Микроскопия живых клеток
Покадровая микроскопия была сделана, как сообщалось ранее 37 . Вкратце, изготовленную на заказ камеру из оргстекла заполняли 400 мкл среды для наблюдения (RPMI 1640 без фенолового красного и 10% FBS).Клетки выращивали на покрытых коллагеном IV (0,1 мг / мл; BD Bioscience, Гейдельберг, Германия) покровных стеклах, прикрепленных к дну камеры. Камера герметизировалась и устанавливалась на предметный столик инвертированного микроскопа. Температура камеры и объектива поддерживалась на уровне 37 ° C с помощью воздушного инкубатора (ASI 400, Nevtek, Burnsville, VA). Изображения получали с помощью широкопольного эпифлуоресцентного микроскопа (Leica Microsystems, DMI6000 B, Wetzlar, Германия), оснащенного программным обеспечением Openlab (Improvision). Изображения собирались с 30-секундными интервалами в течение 45 минут.
Лазерная сканирующая микроскопия и микроскопия структурированного освещения
Изображения получали либо с помощью конфокального микроскопа Leica TCS SP5 (Leica Microsystems, Wetzlar, Германия), либо с масляными иммерсионными объективами 20x / 40x / 63x в программном обеспечении Leica Application Suite (Leica Microsystems, версия 2.6.0) или микроскопом со структурированным освещением (SIM; ELYRA, Carl Zeiss Microscopy GmbH, Йена, Германия), иммерсионным объективом 63x.
Статистический анализ
Все данные представлены как средние значения ± стандартное отклонение или ± стандартная ошибка среднего, проанализированные с помощью непарного теста t с повторными измерениями (n).Различия были определены как значимые при значении p <0,05. Сравнение групп (биопсии человека) проводили с использованием теста Mann-Whitney U .
Все методы были выполнены в соответствии с соответствующими директивами и правилами.
Направленное ингибирование функции фасцина блокирует инвазию опухоли и метастатическую колонизацию
Колония мышей
Мыши с иммунодефицитом NOD-SCID (самки в возрасте от 6 до 8 недель) были приобретены в лаборатории Джексона.Исследования с использованием мышей проводились в соответствии с требованиями Институционального комитета по уходу и использованию животных Медицинского колледжа Вейля Корнельского университета. Всех мышей содержали в помещении Центра ресурсов по исследованиям животных Медицинского колледжа Вейля Корнельского университета.
Культура клеток
Опухолевые клетки молочной железы мыши 4T1 и опухолевые клетки молочной железы человека MDA-MB-231 были получены из Американской коллекции типовых культур. Клетки 4T1 культивировали в среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки (FBS).Клетки MDA-MB-231 культивировали в среде DMEM с добавлением 10% FBS.
Экспрессия и очистка фасцина-1 человека
Рекомбинантный фасцин 1 человека экспрессировался как слитый белок GST в BL21 Escherichia coli . Один литр среды 2YT с ампициллином инокулировали в течение ночи 3 мл культуры BL21 / DE3, трансформированной плазмидой pGEX4T-fasin 1, и выращивали при 37 ° C до тех пор, пока аттенюация при 600 нм (OD 600 ) не достигла примерно 0,5. Затем культуру переносили до 17 ° C и индуцировали добавлением 0.1 мМ изопропил-β-D-тиогалактозид в течение 16 часов. Бактерии собирали центрифугированием при 5000 об / мин. на 10 мин. Осадки суспендировали в 30 мл трис-HCl (20 мМ трис-HCl, pH 8,0, 150 мМ NaCl) с добавлением 0,2 мМ фенилметилсульфонилфторида, 1 мМ дитиотреитола (DTT), 1% тритона X-100 и 1 мМ EDTA. После обработки ультразвуком суспензию центрифугировали при 15000 об / мин. в течение 30 мин, чтобы удалить остатки клеток. Затем супернатант инкубировали в течение 2 ч с 4 мл гранул глутатиона (Sigma) при 4 ° C.После обширной промывки трис-HCl (20 мМ трис-HCl pH 8,0, 150 мМ NaCl) шарики ресуспендировали в 10 мл буфера для расщепления тромбина (20 мМ трис-HCl, pH 8,0, 150 мМ NaCl, 2 мМ CaCl . 2 , 1 мМ DTT). Фасцин высвобождался из шариков путем инкубации в течение ночи с 40–100 Ед тромбина при 4 ° C. После центрифугирования к супернатанту добавляли 0,2 мМ фенилметилсульфонилфторида для инактивации остаточной активности тромбина. Белок фасцина дополнительно концентрировали с помощью Centricon до примерно 50 мг / мл -1 .
Скрининг и анализ химической библиотеки
Низкоскоростной анализ совместной седиментации обычно использовали для исследования активности связывания актина фасцина in vitro . Однако масштабирование такого анализа в условиях высокой пропускной способности нецелесообразно. Мы попробовали анализ AlphaScreen (анализ на основе люминесценции для обнаружения взаимодействия белок-белок) и анализ полимеризации актина (основанный на усиленной флуоресценции конъюгированного с пиреном актина, которая возникает во время полимеризации). Эти два подхода не были многообещающими.Затем мы разработали метод визуализации, в котором мы могли наблюдать связки актина, опосредованные фасцином. Скрининг химической библиотеки был проведен в Ресурсном центре высокопроизводительного скрининга в Университете Рокфеллера. Всего было проверено около 150 000 соединений. Эти химические соединения были из коллекции LOPAC 1280, химической библиотеки Прествика, коллекции Pharmakon, коллекции MicroSource Spectrum, библиотеки Life Chemicals, библиотеки природных соединений Greenpharma, библиотеки Enamine, библиотеки ChemBridge, библиотеки Chem-X-Infinity. и библиотека BioFocus DPI.Пятнадцать микролитров 0,5 мкМ очищенного белка фасцина в буфере (100 мМ KCl, 20 мМ Tris-HCl, pH 7,5, 2 мМ MgCl 2 ) добавляли в каждую лунку прозрачного 384-луночного планшета с плоским дном (Corning), используя Thermo Multidrop Combi (Fisher). Объем 180 нл растворов соединений (5 мМ исходный раствор) из различных химических библиотек переносили булавками из исходных 384-луночных планшетов в 384-луночные аналитические планшеты и инкубировали в течение 30 мин. Затем 15 мкл 0,5 мкМ полимеризованного актина (в 100 мМ KCl, 20 мМ Tris-HCl, pH 7.5, 2 мМ MgCl 2 , 1 мМ DTT, 1 мМ АТФ; Cytoskeleton Inc.), что привело к конечной концентрации химических соединений ~ 30 мкМ. Еще через 30 мин для окрашивания F-актина добавляли 10 мкл фаллоидина Alexa Fluro-488 (25-кратное разведение из исходных запасов в 100% метаноле, Invitrogen) и инкубировали в темноте в течение 1 часа. Затем двадцать пять микролитров смешанного раствора переносили в одну лунку черного 384-луночного планшета, покрытого поли-D-лизином, и окрашенные пучки актина или F-актина прилипали к пластинам с поли-D-лизином.После трехкратной тщательной промывки PBS планшет визуализировали в центре скрининга клеток Weill Cornell с использованием системы скрининга высокого содержания ImageXpress Micro (молекулярные устройства). Лунки отрицательного контроля использовали для контроля качества: на каждом планшете для анализа присутствовало несколько контрольных лунок только с ДМСО (16 лунок на планшет). Для фильтрации желаемых соединений использовались два критерия: z-оценка была меньше -3, и изображения выглядели как изображение только актина. В подтверждающих скринингах около 700 соединений были протестированы в двух экземплярах.Всего было отобрано 145 соединений с подтвержденными ответами, которым предшествовали исследования IC 50 . Коэффициент Z ’составлял 0,5012 для средней длины волокна и 0,5908 для средней ширины волокна, что указывает на надежный анализ, который подходит для HTS.
Источник G2 и химическая характеристика
Соединение G2 изначально было приобретено у BioFocus. Чистота соединения 96%. Молекулярная масса 385,344. Позже G2 был повторно синтезирован ValueTek Inc. 1 H ЯМР (400 МГц, CHLOROFORM-d) δ = 8.73 (с, 1H), 8,09–8,30 (м, 1H), 7,50–7,59 (м, 3H), 7,35–7,43 (м, 1H), 7,24–7,33 (м, 4H), 7,17 (ддд, J = 0,88, 6,99, 8,20 Гц, 1H), 6,58 (дд, J = 1,76, 3,52 Гц, 1H), 5,54 (с, 2H). МС (ESI) m / z : 414 (M + H) +. HRMS (ESI) вычислено для C20h25F3N3O2 (M + H) + m / z = 386,1018, найдено 386,1016.
Получение и анализ изображений с высоким содержанием
Система визуализации ImageXpress MICRO от Molecular Devices, оснащенная дуговой ксеноновой лампой мощностью 300 Вт от Perkin-Elmer, Nikon × 40 Plan Fluor 0.Для получения изображений использовались объектив с числовой апертурой (NA) и камера Photometrics CoolSnapHQ (1392 × 1040 пикселей) от Roper Scientific. Изображения Alexa Fluor 488 были получены с использованием фильтров возбуждения 482/35 нм и эмиссии 536/40 нм с дихроичным длиннопроходным фильтром 513, полученным от Semrock. Планшеты транспортировали из отелей для планшетов с помощью робота CRS CataLyst Express от Thermo Scientific. Изображения были получены в четырех точках на лунку, с выдержкой 1200 мс на изображение с использованием биннинга 2 × 2.Каждый объект был индивидуально сфокусирован с использованием высокоскоростной лазерной автофокусировки, состоящей из диодного лазера с длиной волны 690 нм и специальной 8-битной CMOS-камеры. Время сбора данных составляло 90 мин на пластину. Изображения размером 696 × 520 пикселей были получены при 12 битах интенсивности на пиксель. Размер каждого пикселя составляет 0,3225 × 0,3225 мкм 2 в объекте. Изображения были проанализированы с использованием программного обеспечения для анализа изображений MetaXpress от Molecular Devices. Чтобы исправить затенение, создавалось затененное изображение путем усреднения всех изображений с пластины и сглаживания усредненного изображения с использованием медианного фильтра.Затем каждый пиксель в изображении умножался на среднюю интенсивность затененного изображения, и полученные интенсивности пикселей делились на затененное изображение на попиксельной основе. Фон вычитался из каждого изображения с коррекцией затенения путем умножения интенсивности пикселей на два, затем определения значения интенсивности пятого процентиля результирующего изображения и вычитания этого значения из каждого пикселя изображения. Наконец, была применена маска нерезкости, чтобы минимизировать размытие изображения вне фокуса.Обработанное изображение было ограничено порогом, чтобы сегментировать интересующих объектов от фона. Интегрированная интенсивность и процентная пороговая площадь изображения с пороговым значением были измерены с использованием функции «Показать статистику области» в MetaXpress. Количество объектов, длину и ширину волокна измеряли с помощью функции интегрированного морфометрического анализа MetaXpress. Сумма каждого измерения для четырех участков на лунку была разделена на количество участков, чтобы получить среднее измерение на лунку.Все этапы обработки и измерения изображений выполнялись автоматически для каждого изображения с использованием настраиваемого журнала, который также записывал измерения в электронную таблицу Excel. Z-фактор был рассчитан по следующей формуле:
σ p и σ n — стандартные отклонения положительного (p) и отрицательного (n) контролей, и μ p и µ n — средства положительного и отрицательного контролей.Данные HTS обрабатывались с помощью программного обеспечения Collaborative Drug Discovery и программы R.
Анализ связывания F-актина
Активность связывания актина измеряли с помощью анализа низкоскоростного центрифугирования и флуоресцентной микроскопии. В анализе низкоскоростным центрифугированием мономерный кроличий G-актин был индуцирован для полимеризации при комнатной температуре в буфере F-актина (20 мМ трис-HCl при pH 8, 1 мМ АТФ, 1 мМ DTT, 2 мМ MgCl 2 и 100 мМ KCl). Рекомбинантные белки фасцина (широкого типа или мутантные) затем инкубировали с F-актином в течение 30 минут при комнатной температуре и центрифугировали в течение 15 минут при 10 000 g в настольной центрифуге Eppendorf 5415D.И супернатанты, и осадок растворяли в эквивалентном объеме буфера для образца SDS, и количество актина определяли с помощью SDS-PAGE. Мы измерили интенсивность белков фасцина в гелях, окрашенных кумасси, а затем рассчитали относительную активность связывания актина, P , по следующей формуле: P = 100 × M p / M pc , где P — относительная активность связывания актина, M p — процент актина, присутствующего в осадке при смешивании с различными концентрациями белка фасцина, рассчитанный как (интенсивность в осадке) / (интенсивность в осадке + интенсивность в супернатанте). ), а M pc — процент актина, который присутствует в грануле при смешивании с 0.25 мкМ фасцина, который используется в насыщенной концентрации, определенной в нашем контрольном эксперименте.
При флуоресцентной микроскопии мономерный G-актин полимеризовали, как описано ранее. F-актин смешивали с рекомбинантным белком фасцина в F-буфере (20 мМ Трис-HCl при pH 8, 1 мМ АТФ, 1 мМ DTT, 2 мМ MgCl 2 и 100 мМ KCl) и инкубировали при комнатной температуре в течение 60 мин. . Затем актин метили, добавляя к смеси 2% Alexa 488-фаллоидин. Образцы наносили на покровное стекло, которое было недавно покрыто 1 мг мл -1 поли-D-лизина.После 60 мин инкубации покровное стекло помещали на предметное стекло и снимали изображение с помощью флуоресцентной микроскопии. Были сфотографированы три случайно выбранных поля (× 63 объектива) и подсчитаны пучки. Связки / поле выражали как среднее количество связок ± стандартное отклонение.
Калориметрия изотермического титрования
Калориметрические измерения проводили с использованием прибора Low Volume Nano ITC от TA Instruments. В каждом эксперименте лиганд титровали до раствора белка, присутствующего в ячейке для образца объемом 500 мкл.Контрольная ячейка содержала 0,1 мМ азида натрия, растворенного в бидистиллированной воде. Все измерения проводились при 25 ° C. Белок растворяли в 20 мМ трис-HCl буфере (pH 7,5), 100 мМ NaCl до концентрации 50 мкМ. Концентрации белка определяли с помощью ультрафиолетовой спектроскопии (280 нм) с использованием удельного поглощения, рассчитанного с помощью инструмента ProtParam. Раствор лиганда содержал 1,2 мМ соответствующего ингибитора, растворенного в том же буфере, что и белок. Растворы дегазировали при 25 ° C под вакуумом в течение 10 мин.После экспериментальной установки раствор белка, присутствующий в ячейке для образца, перемешивали со скоростью 320 об / мин. После достижения стабильного исходного уровня начинали титрование. Последовательность инъекций составляла 20 инъекций по 2,4 мкл с интервалами времени 180 с до достижения полного насыщения. Изменения тепла, вызванные каждой инъекцией ингибитора, получали из интеграла калориметрического сигнала. Данные анализировали с использованием программного обеспечения NanoAnalyze (TA Instruments) для подгонки точек к модели независимого связывания.Экспериментальные температуры титрования протеин-ингибитор были скорректированы с учетом теплоты разбавления путем вычитания средней теплоты последних трех измерений после того, как произошло насыщение сайтов связывания протеина. Все измерения проводились как минимум в трех экземплярах. Приведенные значения энергии, константы связывания и стандартные отклонения были получены путем подбора данных и последующего усреднения соответствующих измерений. Стандартные значения свободной энергии Гиббса были рассчитаны с использованием уравнения Δ G 0 = — RT ln K b (где R = 8.3144 Дж моль −1 K −1 , K b константа связывания).
Анализ GST-pull-down
Белки GST или GST-фасцин были экспрессированы в клетках BL21 и очищены на гранулах глутатион-агарозы. Цельноклеточные экстракты клеток 4T1 (обработанных 100 мкМ G2 или без него) инкубировали с белками GST или GST-фасцина (5 мкг) в течение 2 ч при 4 ° C. После трехкратной промывки PBS + 0,1% Triton X-100 для удаления несвязанных белков связанные белки разделяли на SDS-PAGE, наносили электроблоттинг на нитроцеллюлозную мембрану и идентифицировали с помощью антиактина (Santa Cruz Biotechnology, sc-1616, разведение 1: 500 ) или антитела против LIMK1 (Santa Cruz Biotechnology, sc-5576, разведение 1: 200).Сигнал регистрировали по хемилюминесценции. Изображения на рис. 3f, g были обрезаны для презентации. Полноразмерные изображения представлены на дополнительном рисунке 3.
Флуоресцентная микроскопия
Клетки, трансфицированные GFP-фасцином, высевали на покрытые ламинином стеклянные покровные стекла в условиях голодания (без сыворотки) в течение 2 часов с или без G2 (125 мкМ) . Клетки фиксировали 3,7% формальдегидом в PBS в течение 10 минут при комнатной температуре, проницаемостью 0,1% Triton X-100 в течение 5 минут, а затем трижды промывали PBS.Для нетрансфицированных клеток 4T1 для иммунофлуоресцентного окрашивания использовали моноклональные антитела против фасцина (Santa Cruz Biotechnology). Затем покровные стекла помещали на предметные стекла и отображали с помощью конфокальной микроскопии Zeiss LSM510.
Трехмерная миграция клеток
Коллаген типа I экстрагировали из сухожилий хвоста крысы (Pel-Freez Biologicals) путем кислотной солюбилизации, очищали центрифугированием и лиофилизацией и восстанавливали в 0,1% уксусной кислоте в концентрации 10 мг / мл -1 . 100, 200 или 500 мкл исходного раствора коллагена -1 объемом 10 мг / мл разбавляли до 850 мкл путем осторожного перемешивания с 0.1% уксусной кислоты на льду и нейтрализовали до pH 7,0 с помощью 100 мкл 1 М HEPES. 50 мкл MEM, содержащего 50000 клеток MDA-MB-231, затем осторожно смешивали с коллагеном, получая конечную концентрацию коллагена 1,5 мг / мл -1 . Затем 200 мкл раствора геля на лунку выливали в 24-луночный планшет со стеклянным дном (MatTek). Гели инкубировали при 37 ° C в течение 45 минут для полимеризации коллагена, после чего на них наносили 1,5 мл с или без G2 (125 мкМ) предварительно нагретой культуральной среды.
Миграцию отдельных клеток наблюдали с помощью широкоугольной цифровой системы визуализации (Zeiss Axio Observer Z1, камера Hamamatsu ORCA-ER и программное обеспечение Axiovision версии 4.8.1.0), оснащенной камерой для окружающей среды. Фазово-контрастные изображения получали с 30-минутными интервалами в течение 24 часов с использованием сухого объектива × 20 / NA = 0,5 ph3. Передвижение клеток отслеживали с помощью программного обеспечения ImageJ (версия 1.46, Национальные институты здравоохранения). Следили за тем, чтобы эти клетки находились на расстоянии не менее 150 мкм от дна чашки.Количественная оценка клеточного поведения была получена по крайней мере в трех независимых экспериментах, и различные параметры миграции относятся по крайней мере к 60 клеткам. Параметры миграции вычислялись только для плоскости изображения XY, и клетки, движущиеся слишком далеко от фокуса, не анализировались.
Конфокальная визуализация клеток
Для визуализации актина гели коллагена промывали один раз PBS, фиксировали в течение 10 минут при комнатной температуре (RT) 3,7% формальдегидом в PBS, а затем смесью метанол / ацетон (3: 7) в течение 5 минут. при -20 ° С.Актин окрашивали фаллоидином-Alexa Fluor TexasRed (1/100 в PBS) при комнатной температуре в течение 2 часов на качалке. Ядра окрашивали 4,6-диамидино-2-фенилиндолом (0,1 мг мл -1 в PBS) в течение 10 мин при комнатной температуре. Изображения были получены на микроскопе Zeiss LSM 700 с использованием возбуждающих лазерных линий 450, 488 и 543 нм и водно-иммерсионного объектива с числовой апертурой × 40 / 1,1 с использованием программного обеспечения Zen (v. 2010, Carl Zeiss MicroImaging GmbH). Реконструкция трехмерного изображения и количественная оценка выпячивания клеток, площади проекции и соотношения сторон выполнялись с помощью программного обеспечения ImageJ.Толщину выступа клеток измеряли, если выступ был больше одного пикселя в ширину, поскольку меньшие выступы не всегда могут быть видны в зависимости от глубины визуализации внутри коллагенового геля в настоящих условиях визуализации.
Анализ миграции клеток в камере Бойдена
Клетки MDA-MB-231 (510 4 ) или клетки 4T1 (110 5 ), суспендированные в 100 мкл голодной среды, добавляли в верхнюю камеру вставки (диаметром 6,5 мм). , Размер пор 8 мкм; Becton Dickson), и вставку помещали в 24-луночный планшет, содержащий 700 мкл голодной среды с 10% FBS или без него.При использовании ингибиторы добавляли как в верхнюю, так и в нижнюю камеры. Анализы миграции проводили в течение 6 часов, и клетки фиксировали 3,7% формальдегидом. Клетки окрашивали раствором для окрашивания кристаллическим фиолетовым, а клетки с верхней стороны вставки удаляли ватным тампоном. Были сфотографированы три случайно выбранных поля (десять объективов) на нижней стороне вставки и подсчитаны мигрировавшие клетки. Миграцию выражали как среднее количество мигрировавших клеток в поле.
Анализы образования колоний на мягком агаре
Клетки 4T1 и клетки MDA-MB-231 поддерживали в RPMI с добавлением пенициллина / стрептомицина и 10% FBS. Рост клеток, не зависящий от закрепления, оценивали с помощью анализа образования колоний в мягком агаре. Вкратце, в каждую лунку 12-луночного планшета добавляли 2 мл 0,8% агара. Отделенные клетки (с или без 150 мкМ G2) смешивали с суспензией агарозы (конечная концентрация 0,4%), а затем наслаивали на 0,8% агарозную подложку. Среду для культивирования меняли каждые 3 дня, и через 2 недели подсчитывали количество клеточных очагов диаметром ≥100 мм).Каждый эксперимент проводился в трех экземплярах.
Анализ каспазы
Анализ активности каспазы выполняли, как описано 60 . Вкратце, клетки обрабатывали G2 в разные моменты времени. Плавающие и прикрепленные клетки (собранные трипсинизацией) лизировали. Затем двадцать микрограммов клеточного лизата смешивали с субстратом каспазы-3 (апопаин) родамином 110 (AnaSpec; конечная концентрация 1,5 мкМ) на льду в конечном объеме 20 мкл. Затем образцы немедленно загружали в 96-луночные планшеты и измеряли флуоресценцию при 30 ° C в течение 180 мин с использованием TECAN при возбуждении и испускании 485 и 535 нм соответственно.Были нанесены средние относительные единицы флуоресценции через 120 мин и s.e.m. минимум трех независимых анализов.
Метастаз опухоли молочной железы 4T1 у мышей
Самок мышей BALB / c (в возрасте от 6 до 8 недель) были приобретены у Charles River. Опухолевые клетки 4T1 (1 × 10 6 ) вводили подкожно в область брюшной молочной железы мышей, используя 0,1 мл суспензии одноклеточных клеток в PBS в день 0. Начиная с дня 7, когда опухоли в среднем составляли около ~ 4–4%. Диаметр 5 мм, G2 или контрольный растворитель вводили каждый день внутрибрюшинной инъекцией в дозе 100 мг / кг -1 на мышь до 24 дня.На 25 день мышей умерщвляли. Этот режим дозирования хорошо переносился без признаков явной токсичности. В каждой группе было по пять мышей. Количество метастатических клеток 4T1 в легких определяли с помощью клоногенного анализа. Вкратце, легкие удаляли у каждой мыши на 25 день, мелко измельчали и переваривали в 5 мл коктейля ферментов, содержащего 1 × PBS и 1 мг мл -1 коллагеназы типа IV, в течение 2 часов при 37 ° C на платформе-качалке. После инкубации образцы фильтровали через нейлоновые сетчатые фильтры размером 70 мкм и дважды промывали PBS.Полученные клетки суспендировали, высевали с серией разведений на чашки для тканевых культур диаметром 10 см в среде RPMI 1640, содержащей 60 мкМ тиогуанина, для клоногенного роста. Поскольку опухолевые клетки 4T1 устойчивы к 6-тиогуанину, метастазированные опухолевые клетки образовывали очаги через 7 дней, после чего их фиксировали метанолом и окрашивали 0,03% метиленовым синим для подсчета.
MDA-MB-231 Метастаз опухоли молочной железы человека у мышей
Все работы с животными выполняли в соответствии с протоколами, утвержденными Комитетом по уходу и использованию институциональных животных Медицинского колледжа Вейля Корнельского университета.Мышей Athymic Nude (Foxn1 nu ) с иммунодефицитом приобретали в лаборатории Харлана. Клетки опухоли молочной железы человека MDA-MB-231, экспрессирующие усиленный слитый белок GFP-люцифераза, трипсинизировали и дважды промывали PBS. Мышей анестезировали 2% изофлураном. 10 6 клеток в 0,1 мл PBS вводили в боковую хвостовую вену с помощью иглы калибра 27 × ½ ’’. Мышей немедленно помещали на черную подушечку в боксе для визуализации IVIS и визуализировали вентрально. Визуализацию животных проводили один раз в неделю в течение 7 недель.G2 был i.p. вводили по 100 мг кг -1 ежедневно.
Фармакокинетическое исследование G2 на мышах
Фармакокинетику G2 определяли на мышах B6D2F1 после однократного внутривенного введения (20 мг на кг массы тела). Образцы крови собирали в пробирки, покрытые ЭДТА, с интервалами времени от 5 минут до 4 часов после введения дозы и центрифугировали при 1500 g в течение 15 минут для получения образцов плазмы. Фармакокинетические параметры, включая площадь под кривой, пиковую концентрацию G2 в плазме после введения ( C макс. ) и период полувыведения ( T 1/2 ), оценивали с помощью двухкомпонентной аппроксимации данные.Образцы плазмы экстрагировали смесью ацетонитрила, 0,1% муравьиной кислоты и воды, перемешивали и центрифугировали. Супернатанты анализировали с использованием Agilent HPLC / MS (6120), оборудованного колонкой Kinetex C18 (100 × 3 мм 2 , размер частиц 2,6 мкм) и защитной колонкой. Стандартные кривые получали путем добавления соединений в контрольную плазму, и их использовали для определения концентраций лекарственного средства.
Индийские чернила для анализа
Для анализа метастазов опухоли в легкие мышей умерщвляли, их легкие удаляли и вводили индейские чернила для визуализации отдельных опухолевых узлов.Вкратце, в изолированные легкие внутритрахеально вводили чернила India (15% India Ink, 85% воды, 3 капли NH 4 OH / 100 мл). Легкие с инъецированными чернилами промывали раствором Фекета (300 мл 70% EtOH, 30 мл 37% формальдегида, 5 мл ледяной уксусной кислоты), а затем помещали в свежий раствор Фекета на ночь. Узлы опухоли не впитывают чернила, в результате чего нормальная ткань легкого окрашивается в черный цвет, а узелки опухоли остаются белыми.
Визуализация IVIS
Для системы IVIS время экспозиции настраивается таким образом, чтобы не было насыщенного сигнала.Изображения берутся с использованием 8 бункеров на уровне D. Для получения изображений была выбрана единица «количество». Для количественной оценки сигналов была выбрана интересующая область и использованы «фотоны». В этом режиме измерения или изображения автоматически учитывают различные настройки времени интегрирования, биннинга, диафрагмы и поля обзора.
Гистология
Мышей анестезировали и впоследствии перфузировали PBS и 4% параформальдегидом, забуференным PBS. Легкие надували 1% легкоплавкой агарозой, обрабатывали для парафиновых срезов на 8 мкм и окрашивали H&E.
Исследование токсичности на мышах
Мышам с иммунодефицитом NOD-SCID (самки мышей в возрасте 6-8 недель, n = 3 на группу) вводили либо контрольный носитель (ДМСО), либо 100 мг / кг -1 G2 составной IP ежедневно, 5 дней в неделю, в течение 2 недель. Вес тела и клинические признаки регистрировались ежедневно. Во время умерщвления (день 15) мышей собирали кровь для клинического химического анализа и всех мышей проводили полное вскрытие трупа. Ткани фиксировали, обрабатывали, заливали парафином, делали срезы и окрашивали H&E.Основные органы, включая сердце, легкие, почки, селезенку, печень, поджелудочную железу, лимфатические узлы и кишечник, были исследованы под микроскопом.
Статистический анализ
Данные выражены как среднее ± s.e.m. и проанализированы с помощью теста Стьюдента t со значимостью, определяемой как P <0,05.
Сверхэкспрессия фасцина способствует неопластическому прогрессированию плоскоклеточного рака полости рта | BMC Cancer
Parkin DM, Bray F, Ferlay J, Pisani P: Глобальная статистика рака, 2002.CA Cancer J Clin. 2005, 55: 74-108. 10.3322 / canjclin.55.2.74.
Артикул PubMed Google Scholar
Сано Д., Майерс Дж. Н.: Метастаз плоскоклеточного рака ротовой полости. Раковые метастазы Rev.2007, 26: 645-662. 10.1007 / s10555-007-9082-у.
CAS Статья PubMed Google Scholar
Rusthoven K, Ballonoff A, Raben D, Chen C: Плохой прогноз у пациентов с плоскоклеточным раком полости рта I и II стадии.Рак. 2008, 112: 345-351. 10.1002 / cncr.23183.
Артикул PubMed Google Scholar
de Aguiar AF, Kowalski LP, de Almeida OP: Клинико-патологическая и иммуногистохимическая оценка плоскоклеточного рака полости рта у пациентов с ранним местным рецидивом. Oral Oncol. 2007, 43: 593-601. 10.1016 / j.oraloncology.2006.07.003.
Артикул PubMed Google Scholar
Mucke T, Wagenpfeil S, Kesting MR, Holzle F, Wolff KD: Интервал рецидива влияет на выживаемость после местного рецидива рака полости рта. Oral Oncol. 2009, 45: 687-691. 10.1016 / j.oraloncology.2008.10.011.
Артикул PubMed Google Scholar
Woolgar JA: Гистопатологические прогностические факторы плоскоклеточного рака полости рта и ротоглотки. Oral Oncol. 2006, 42: 229-239. 10.1016 / j.oraloncology.2005.05.008.
Артикул PubMed Google Scholar
Kureishy N, Sapountzi V, Prag S, Anilkumar N, Adams JC: Fascins и их роли в структуре и функциях клеток. Биологические исследования. 2002, 24: 350-361. 10.1002 / bies.10070.
CAS Статья PubMed Google Scholar
Брайан Дж., Эдвардс Р., Мацудайра П., Отто Дж., Вулфкуле Дж.: Fascin, связывающий актин белок ехиноида, является гомологом продукта гена, выделенного дрозофилой. Proc Natl Acad Sci USA. 1993, 90: 9115-9119. 10.1073 / pnas.90.19.9115.
CAS Статья PubMed PubMed Central Google Scholar
Аль-Алван М.М., Роуден Г., Ли Т.Д., Вест К.А. Фасцин участвует в активности презентации антигена зрелых дендритных клеток. J Immunol. 2001, 166: 338-345.
CAS Статья PubMed Google Scholar
Cohan CS, Welnhofer EA, Zhao L, Matsumura F, Yamashiro S: Роль связывающего актин белка фасцина в морфогенезе конуса роста: локализация в филоподиях и ламеллиподиях.Цитоскелет клеточного мотиля. 2001, 48: 109-120. 10.1002 / 1097-0169 (200102) 48: 2 <109 :: AID-CM1002> 3.0.CO; 2-G.
CAS Статья PubMed Google Scholar
Mosialos G, Yamashiro S, Baughman RW, Matsudaira P, Vara L, Matsumura F, Kieff E., Birkenbach M: вирусная инфекция Эпштейна-Барра индуцирует экспрессию в B-лимфоцитах нового гена, кодирующего эволюционно консервативный 55- килодальтон-связывающий белок актин. J Virol. 1994, 68: 7320-7328.
CAS PubMed PubMed Central Google Scholar
Хашимото Ю., Скасел М., Адамс Дж. К.: Роль фасцина в подвижности карциномы человека и передаче сигналов: перспективы нового биомаркера ?. Int J Biochem Cell Biol. 2005, 37: 1787-1804. 10.1016 / j.biocel.2005.05.004.
CAS Статья PubMed Google Scholar
Grothey A, Hashizume R, Ji H, Tubb BE, Patrick CW, Yu D, Mooney EE, McCrea PD: C-erbB-2 / HER-2 активирует фасцин, связывающий актин белок, связанный с клеткой. подвижность в клеточных линиях рака груди человека.Онкоген. 2000, 19: 4864-4875. 10.1038 / sj.onc.1203838.
CAS Статья PubMed Google Scholar
Grothey A, Hashizume R, Sahin AA, McCrea PD: Fascin, связывающий актин белок, связанный с подвижностью клеток, активируется при раке молочной железы, отрицательном по рецепторам гормонов. Br J Рак. 2000, 83: 870-873. 10.1054 / bjoc.2000.1395.
CAS Статья PubMed PubMed Central Google Scholar
Hu W, McCrea PD, Deavers M, Kavanagh JJ, Kudelka AP, Verschraegen CF: Повышенная экспрессия фасцина, белка, связанного с подвижностью, в культурах клеток, полученных из рака яичников, а также в пограничных и карциноматозных опухолях яичников. Clin Exp Metastasis. 2000, 18: 83-88. 10.1023 / А: 1026596609969.
CAS Статья PubMed Google Scholar
Гончарук В.Н., Росс Дж. С., Карлсон Дж. А. Экспрессия актин-связывающего белка фасцина при неоплазии кожи.Дж. Кутан Патол. 2002, 29: 430-438. 10.1034 / j.1600-0560.2002.2.x.
Артикул PubMed Google Scholar
Iacobuzio-Donahue CA, Ashfaq R, Maitra A, Adsay NV, Shen-Ong GL, Berg K, Hollingsworth MA, Cameron JL, Yeo CJ, Kern SE и др.: Высокоэкспрессируемые гены в аденокарциномах протоков поджелудочной железы : всесторонняя характеристика и сравнение профилей транскрипции, полученных с помощью трех основных технологий. Cancer Res.2003, 63: 8614-8622.
CAS PubMed Google Scholar
Maitra A, Iacobuzio-Donahue C, Rahman A, Sohn TA, Argani P, Meyer R, Yeo CJ, Cameron JL, Goggins M, Kern SE и др .: Иммуногистохимическая проверка нового эпителия и романа стромальный маркер аденокарциномы протока поджелудочной железы, идентифицированный с помощью микрочипов глобальной экспрессии: гомолог фасцина морского ежа и белок теплового шока 47. Am J Clin Pathol. 2002, 118: 52-59.10.1309 / 3PAM-P5WL-2LV0-R4EG.
CAS Статья PubMed Google Scholar
Игучи Т., Айшима С., Умеда К., Санэфудзи К., Фудзита Н., Сугимачи К., Гион Т., Такэтоми А., Маэхара И., Цунэёси М.: Экспрессия Fascin в прогрессировании и прогнозе гепатоцеллюлярной карциномы. J Surg Oncol. 2009, 100: 575-579. 10.1002 / jso.21377.
Артикул PubMed Google Scholar
Machesky LM, Li A: Fascin: инвазивные филоподии, способствующие метастазированию. Коммуна Интегр Биол. 3: 263-270.
Pelosi G, Pasini F, Fraggetta F, Pastorino U, Iannucci A, Maisonneuve P, Arrigoni G, De Manzoni G, Bresaola E, Viale G: Независимое значение иммунореактивности фасцина для прогнозирования метастазов в лимфатических узлах при типичных и атипичные карциноиды легких. Рак легких. 2003, 42: 203-213. 10.1016 / S0169-5002 (03) 00294-0.
Артикул PubMed Google Scholar
Хашимото Ю., Ито Т., Иноуэ Х, Окумура Т., Танака Е., Цунода С., Хигасияма М., Ватанабе Г., Имамура М., Шимада Ю.: прогностическое значение сверхэкспрессии фасцина при плоскоклеточной карциноме пищевода человека. Clin Cancer Res. 2005, 11: 2597-2605. 10.1158 / 1078-0432.CCR-04-1378.
CAS Статья PubMed Google Scholar
Hashimoto Y, Skacel M, Lavery IC, Mukherjee AL, Casey G, Adams JC: Прогностическое значение экспрессии фасцина при распространенном колоректальном раке: иммуногистохимическое исследование колоректальных аденом и аденокарцином.BMC Рак. 2006, 6: 241-10.1186 / 1471-2407-6-241.
Артикул PubMed PubMed Central Google Scholar
Zhang H, Xu L, Xiao D, Xie J, Zeng H, Cai W, Niu Y, Yang Z, Shen Z, Li E: Fascin является потенциальным биомаркером для ранней стадии плоскоклеточного рака пищевода. J Clin Pathol. 2006, 59: 958-964. 10.1136 / jcp.2005.032730.
CAS Статья PubMed PubMed Central Google Scholar
Zigeuner R, Droschl N, Tauber V, Rehak P, Langner C: Биологическое значение экспрессии фасцина в светлоклеточной почечно-клеточной карциноме: систематический анализ первичных и метастатических опухолевых тканей с использованием метода тканевого микрочипа. Урология. 2006, 68: 518-522. 10.1016 / j.urology.2006.03.032.
Артикул PubMed Google Scholar
Puppa G, Maisonneuve P, Sonzogni A, Masullo M, Chiappa A, Valerio M, Zampino MG, Franceschetti I, Capelli P, Chilosi M, et al: Независимое прогностическое значение иммунореактивности фасцинов на стадии III-IV аденокарцинома толстой кишки.Br J Рак. 2007, 96: 1118-1126. 10.1038 / sj.bjc.6603690.
CAS Статья PubMed PubMed Central Google Scholar
Chen SF, Yang SF, Li JW, Nieh PC, Lin SY, Fu E, Bai CY, Jin JS, Lin CY, Nieh S: Экспрессия фасцина при плоскоклеточном раке полости рта и ротоглотки имеет прогностическое значение — исследование тканевых микрочипов 129 случаев. Histopathol. 2007, 51: 173-183. 10.1111 / j.1365-2559.2007.02755.x.
CAS Статья Google Scholar
Alam H, Kundu ST, Dalal SN, Vaidya MM: потеря кератинов 8 и 18 приводит к изменениям в передаче сигналов, опосредованной альфа6бета4-интегрином, и снижению неопластической прогрессии в клеточной линии, полученной из опухоли полости рта. J Cell Sci. 2011, 124: 2096-2106. 10.1242 / jcs.073585.
CAS Статья PubMed Google Scholar
Рауль Ю., Савант С., Данге П., Калрайя Р., Ингл А., Вайдья М.: Последствия образования филаментов цитокератина 8/18 в многослойных эпителиальных клетках: индукция трансформированного фенотипа.Int J Cancer. 2004, 111: 662-668. 10.1002 / ijc.20349.
CAS Статья PubMed Google Scholar
Алам Х., Сегал Л., Кунду С.Т., Далал С.Н., Вайдья М.М.: Новая функция кератинов 5 и 14 в пролиферации и дифференцировке многослойных эпителиальных клеток. Mol Biol Cell. 2011, 22: 4068-4078. 10.1091 / mbc.E10-08-0703.
CAS Статья PubMed PubMed Central Google Scholar
Elbert M, Cohen D, Musch A: PAR1b способствует адгезии клеток к клеткам и ингибирует трансформацию, опосредованную растрепанием, почечных клеток собак Madin-Darby. Mol Biol Cell. 2006, 17: 3345-3355. 10.1091 / mbc.E06-03-0193.
CAS Статья PubMed PubMed Central Google Scholar
Дуа П., Ингл А., Гуде Р.П. Сурамин усиливает противоопухолевую и антиметастатическую активность пентоксифиллина при меланоме B16F10. Int J Cancer.2007, 121: 1600-1608. 10.1002 / ijc.22843.
CAS Статья PubMed Google Scholar
Heussen C, Dowdle EB: Электрофоретический анализ активаторов плазминогена в полиакриламидных гелях, содержащих додецилсульфат натрия и сополимеризованные субстраты. Анальная биохимия. 1980, 102: 196-202. 10.1016 / 0003-2697 (80)
CAS Статья PubMed Google Scholar
Алам Х., Гангадаран П., Бхате А.В., Чаукар Д.А., Савант С.С., Тивари Р., Бобаде Дж., Каннан С., Д’Круз А.К., Кейн С., Вайдья М.М.: потеря фосфорилирования кератина 8 ведет к усиленному прогрессированию опухоли и коррелирует с клиническими данными. -Патологические параметры пациентов с OSCC. PLoS One. 2011, 6: e27767-10.1371 / journal.pone.0027767.
CAS Статья PubMed PubMed Central Google Scholar
Вигневич Д., Кодзима С., Аратын Ю., Данчу О., Свиткина Т., Бориси Г.Г .: Роль фасцина в филоподиальном протрузии.J Cell Biol. 2006, 174: 863-875. 10.1083 / jcb.200603013.
CAS Статья PubMed PubMed Central Google Scholar
Адамс Дж. К.: Роль фасцина в адгезии и подвижности клеток. Curr Opin Cell Biol. 2004, 16: 590-596. 10.1016 / j.ceb.2004.07.009.
CAS Статья PubMed Google Scholar
Yamashiro S, Yamakita Y, Ono S, Matsumura F: Fascin, связывающий актин белок, вызывает выпячивание мембран и увеличивает подвижность эпителиальных клеток.Mol Biol Cell. 1998, 9: 993-1006.
CAS Статья PubMed PubMed Central Google Scholar
Кудо Ю., Китадзима С., Огава И., Хираока М., Сарголзаи С., Кейхаи М.Р., Сато С., Мияучи М., Таката Т.: Инвазия и метастазирование раковых клеток полости рта требует метилирования Е-кадгерина и / или деградации мембранного бета-катенина. Clin Cancer Res. 2004, 10: 5455-5463. 10.1158 / 1078-0432.CCR-04-0372.
CAS Статья PubMed Google Scholar
Laxmidevi LB, Angadi PV, Pillai RK, Chandreshekar C: Аберрантная экспрессия бета-катенина в гистологической дифференциации плоскоклеточной карциномы полости рта и веррукозной карциномы: иммуногистохимическое исследование. J Oral Sci. 52: 633-640.
Wang L, Liu T, Wang Y, Cao L, Nishioka M, Aguirre RL, Ishikawa A, Geng L, Okada N: измененная экспрессия десмоколлина 3, десмоглеина 3 и бета-катенина в плоских клетках ротовой полости карцинома: корреляция с метастазами в лимфатические узлы и пролиферацией клеток.Арка Вирхова. 2007, 451: 959-966. 10.1007 / s00428-007-0485-5.
CAS Статья PubMed Google Scholar
Hashimoto Y, Parsons M, Adams JC: Двойная активность фасцина по связыванию актина и протеинкиназы C регулирует миграцию клеток карциномы ниже Rac и способствует метастазированию. Mol Biol Cell. 2007, 18: 4591-4602. 10.1091 / mbc.E07-02-0157.
CAS Статья PubMed PubMed Central Google Scholar
Xie JJ, Xu LY, Zhang HH, Cai WJ, Mai RQ, Xie YM, Yang ZM, Niu YD, Shen ZY, Li EM: Роль фасцина в пролиферации и инвазивности клеток карциномы пищевода. Biochem Biophys Res Commun. 2005, 337: 355-362. 10.1016 / j.bbrc.2005.09.055.
CAS Статья PubMed Google Scholar
Jawhari AU, Buda A, Jenkins M, Shehzad K, Sarraf C, Noda M, Farthing MJ, Pignatelli M, Adams JC: Fascin, связывающий актин белок, модулирует инвазивность и дифференцировку эпителиальных клеток толстой кишки in vitro .Am J Pathol. 2003, 162: 69-80. 10.1016 / S0002-9440 (10) 63799-6.
CAS Статья PubMed PubMed Central Google Scholar
Hwang JH, Smith CA, Salhia B, Rutka JT: Роль фасцина в миграции и инвазивности злокачественных клеток глиомы. Неоплазия. 2008, 10: 149-159. 10.1593 / neo.07909.
CAS Статья PubMed Google Scholar
Chen L, Yang S, Jakoncic J, Zhang JJ, Huang XY: аналоги миграстатина нацелены на фасцин, чтобы блокировать метастазирование опухоли. Природа. 464: 1062-1066.
Liotta LA, Tryggvason K, Garbisa S, Hart I, Foltz CM, Shafie S: Метастатический потенциал коррелирует с ферментативной деградацией коллагена базальной мембраны. Природа. 1980, 284: 67-68. 10.1038 / 284067a0.
CAS Статья PubMed Google Scholar
Thiery JP: Эпителиально-мезенхимальные переходы при прогрессировании опухоли.Нат Рев Рак. 2002, 2: 442-454. 10.1038 / nrc822.
CAS Статья PubMed Google Scholar
Vignjevic D, Schoumacher M, Gavert N, Janssen KP, Jih G, Lae M, Louvard D, Ben-Ze’ev A, Robine S: Fascin, новая мишень передачи сигналов бета-катенин-TCF, экспрессируется на инвазивном фронте рака толстой кишки человека. Cancer Res. 2007, 67: 6844-6853. 10.1158 / 0008-5472.CAN-07-0929.
CAS Статья PubMed Google Scholar
Friedl P: Предварительная спецификация и пластичность: смещение механизмов миграции клеток. Curr Opin Cell Biol. 2004, 16: 14-23. 10.1016 / j.ceb.2003.11.001.
CAS Статья PubMed Google Scholar
Гумбинер Б.М.: Клеточная адгезия: молекулярная основа архитектуры и морфогенеза тканей. Клетка. 1996, 84: 345-357. 10.1016 / S0092-8674 (00) 81279-9.
CAS Статья PubMed Google Scholar
Hynes RO, Lander AD: Контактная и адгезивная специфичность в ассоциациях, миграциях и нацеливании клеток и аксонов. Клетка. 1992, 68: 303-322. 10.1016 / 0092-8674 (92)
CAS Статья PubMed Google Scholar
Lyons AJ, Jones J: Молекулы клеточной адгезии, внеклеточный матрикс и плоскоклеточная карцинома полости рта. Int J Oral Maxillofac Surg. 2007, 36: 671-679. 10.1016 / j.ijom.2007.04.002.
CAS Статья PubMed Google Scholar
Adams JC: Образование стабильных микрошипов, содержащих актин и связывающий актин белок массой 55 кДа, фасцин, является следствием клеточной адгезии к тромбоспондину-1: последствия для антиадгезивной активности тромбоспондина-1. J Cell Sci. 1995, 108 (Pt 5): 1977–1990.
CAS PubMed Google Scholar
Adams JC, Clelland JD, Collett GD, Matsumura F, Yamashiro S, Zhang L: Адгезии клеточного матрикса по-разному регулируют фосфорилирование фасцина.Mol Biol Cell. 1999, 10: 4177-4190.
CAS Статья PubMed PubMed Central Google Scholar
Anilkumar N, Parsons M, Monk R, Ng T, Adams JC: Взаимодействие фасцина и протеинкиназы Calpha: новое пересечение в клеточной адгезии и подвижности. Embo J. 2003, 22: 5390-5402. 10.1093 / emboj / cdg521.
CAS Статья PubMed PubMed Central Google Scholar
Ortiz CM, Ito T, Hashimoto Y, Nagayama S, Iwai A, Tsunoda S, Sato F, Martorell M, Garcia JA, Perez A, Shimada Y: Эффекты малых интерферирующих РНК, нацеленных на фасцин, на клеточные линии плоскоклеточной карциномы пищевода человека. Diagn Pathol. 2010, 5: 41-10.1186 / 1746-1596-5-41.
Артикул PubMed PubMed Central Google Scholar
Pelosi G, Pastorino U, Pasini F, Maissoneuve P, Fraggetta F, Iannucci A, Sonzogni A, De Manzoni G, Terzi A, Durante E, et al: Независимое прогностическое значение иммунореактивности фасцинов на стадии I nonmall клеточный рак легкого.Br J Рак. 2003, 88: 537-547. 10.1038 / sj.bjc.6600731.
CAS Статья PubMed PubMed Central Google Scholar
Wagner EF, Nebreda AR: Интеграция сигналов с помощью путей JNK и p38 MAPK в развитии рака. Нат Рев Рак. 2009, 9: 537-549. 10.1038 / nrc2694.
CAS Статья PubMed Google Scholar
Робертс П.Дж., Der CJ: Нацеливание на каскад митоген-активируемой протеинкиназы Raf-MEK-ERK для лечения рака.Онкоген. 2007, 26: 3291-3310. 10.1038 / sj.onc.1210422.
CAS Статья PubMed Google Scholar
Vivanco I., Sawyers CL: Путь фосфатидилинозитол-3-киназы AKT при раке человека. Нат Рев Рак. 2002, 2: 489-501. 10.1038 / nrc839.
CAS Статья PubMed Google Scholar
Рао Дж.С.: Молекулярные механизмы инвазивности глиомы: роль протеаз.Нат Рев Рак. 2003, 3: 489-501. 10.1038 / nrc1121.
CAS Статья PubMed Google Scholar
Вестермарк Дж, Кахари В.М.: Регулирование экспрессии матриксной металлопротеиназы при опухолевой инвазии. Faseb J. 1999, 13: 781-792.
CAS PubMed Google Scholar
Лев Д.К., Онн А., Мелинкова В.О., Миллер С., Стоун В., Руис М., МакГари ЕС, Анантасвами Н.Н., Прайс Дж. Э., Бар-Эли М.: Воздействие дакарбазина на клетки меланомы приводит к усиленному росту опухоли и метастазирование in vivo.J Clin Oncol. 2004, 22: 2092-2100. 10.1200 / JCO.2004.11.070.
CAS Статья PubMed Google Scholar
Lim J, Kim JH, Paeng JY, Kim MJ, Hong SD, Lee JI, Hong SP: Прогностическое значение экспрессии активированных Akt при плоскоклеточном раке полости рта. J Clin Pathol. 2005, 58: 1199-1205. 10.1136 / jcp.2004.024786.
CAS Статья PubMed PubMed Central Google Scholar
Шингаки С., Такада М., Сасай К., Биби Р., Кобаяши Т., Номура Т., Сайто С. Влияние метастазов в лимфатические узлы на характер неудач и выживаемость при карциномах полости рта. Am J Surg. 2003, 185: 278-284. 10.1016 / S0002-9610 (02) 01378-8.
Артикул PubMed Google Scholar
Massano J, Regateiro FS, Januario G, Ferreira A: Плоскоклеточный рак полости рта: обзор прогностических и прогностических факторов. Oral Surg Oral Med Oral Pathol Oral Radiol Endod.2006, 102: 67-76. 10.1016 / j.tripleo.2005.07.038.
Артикул PubMed Google Scholar
Ферлито А., Ринальдо А., Роббинс К.Т., Лиманс К.Р., Шах Дж. П., Шаха А.Р., Андерсен П.Е., Ковальски Л.П., Пеллиттери П.К., Клейман Г.Л. и др.: Изменение концепций хирургического лечения метастазов в шейных узлах. . Oral Oncol. 2003, 39: 429-435. 10.1016 / S1368-8375 (03) 00010-1.
Артикул PubMed Google Scholar
Woolgar JA, Rogers SN, Lowe D, Brown JS, Vaughan ED: Метастазы в шейные лимфатические узлы при раке полости рта: важность даже микроскопического экстракапсулярного распространения. Oral Oncol. 2003, 39: 130-137. 10.1016 / S1368-8375 (02) 00030-1.
CAS Статья PubMed Google Scholar
Гринберг Дж. С., Эль Наггар А. К., Мо В., Робертс Д., Майерс Дж. Н.: Несоответствие в патологической и клинической стадии лимфатических узлов при карциноме ротового языка. Значение для принятия терапевтического решения.Рак. 2003, 98: 508-515. 10.1002 / cncr.11526.
Артикул PubMed Google Scholar
Lo WL, Kao SY, Chi LY, Wong YK, Chang RC: исходы плоскоклеточного рака полости рта в Тайване после хирургической терапии: факторы, влияющие на выживаемость. J Oral Maxillofac Surg. 2003, 61: 751-758. 10.1016 / S0278-2391 (03) 00149-6.
Артикул PubMed Google Scholar
Lee TK, Poon RT, Man K, Guan XY, Ma S, Liu XB, Myers JN, Yuen AP: сверхэкспрессия Fascin связана с агрессивностью плоскоклеточного рака полости рта. Cancer Lett. 2007, 254: 308-315. 10.1016 / j.canlet.2007.03.017.
CAS Статья PubMed Google Scholar
FMNL2 регулирует динамику фашина в филоподиях | Журнал клеточной биологии
Были использованы следующие антитела: мышиное моноклональное антитело против фасцина (Dako), анти-фасцин pS39 (Abcam), мышиное антитело против GFP (Roche), анти-FMNL2 / 3 (Abcam), анти-Profilin1 и анти-Profilin2. (Cell Signaling) и анти-DAAM1 (Санта-Крус), анти-GAPDH (Chemicon).Антитела, конъюгированные с HRP мыши и кролика, были приобретены у Dako, а вторичные антитела, связанные с AF555 и AF647, были у Life Technologies. Были использованы следующие соединения: CK666 и Jasplakinolide (Santa Cruz), SMIFh3 (Tocris), Cytochalasin D (Sigma-Aldrich), BIM (Sigma-Aldrich), форбол 12,13-дибутират (Sigma-Aldrich), тетрадеканоил форболат ( Sigma-Aldrich) и Kinesore (любезно предоставлены Марком Доддингом, Бристольский университет, Великобритания). Монореактивный краситель Cy5 и набор для диализа были от GE Healthcare, коллаген I из хвоста крысы был приобретен у Corning, а рибоза — у AppliChem.Модифицированные карбоксилатом микрошарики AF647 (диаметр 0,2 мкм) были любезно предоставлены командой Advanced Image Center (исследовательский центр Janelia). Для создания стабильных клеток HeLa с нокдауном фасцина мы использовали shRNA 5′-GCC TGA AGA AGA AGC AGA TCT-3 ‘, клонированную в pLKO (консорциум RNAi), и использовали клетки либо для временной трансфекции, либо для стабильной вирусной трансфекции. трансдукция GFP-фасцина и mEOS2-фасцина, как описано ранее (Jayo et al., 2016). Эффектен (Qiagen) использовался для трансфекций ДНК, а Dharmafect (Dharmacon) — для трансфекций siRNA.Для временной экспрессии использовали следующие плазмиды: GFP-fasin WT, RFP-fasin WT, RFP-fasin-S39A, RFP-fasin-S39D, CS-fasin, CS-fasin-S39A, CS-fasin-S39D, mScarlet-lifeact. , RFP-актин, mEOS2-фасцин, FMNL2-GFP (Block et al., 2012; Kage et al., 2017), FMNL2ΔDAD-GFP (полученный путем субклонирования FMNL2ΔDAD из Block et al. [2012]), FMNL2-A272E- GFP (Woodham et al., 2017), FMNL3-GFP, FMNL3act-GFP (Kage et al., 2017), GFP-DAAM1 и GFP-DAAM1ΔDAD (Liu et al., 2008). Конструкции GST FMNL2 описаны в Kühn et al.(2015). Для создания CS-фасцина GFP-фасцин в pEGFP-C1 был мутирован с использованием набора для мутагенеза Q5 (NEB) для создания сайтов рестрикции внутри неконтролируемой петли в домене 3 фасцина, который, как предполагается, обращен к внешней стороне молекулы в закрытом , шаровидное строение. Пулы миРНК On-TARGET, направленные против FMNL2, FMNL3, DAAM1, Profilin-1 и Profilin-2 или контрольные миРНК, были от Dharmacon. Единый контроль или миРНК против FMNL2 были от Sigma-Aldrich (SASI_Hs01_00144237 и SASI_Hs02_00361655).
Fascin | MBInfo
Фасцин является основным сшивающим с актином белком, обнаруживаемым в широком диапазоне филоподий [1] [2] [3]. Этот белок, как было показано, работает совместно с другими сшивающими линкерами, такими как α-actinin, с образованием филоподий, хотя самого фасцина достаточно для образования филоподий-подобных пучков в системе восстановления [4]. Более того, фасцин и α-актинин совместно локализуются в основании филоподий, где вместе они могут вызывать механический ответ большей силы, чем при действии по отдельности [5].Клетки, несущие дефектный фасцин, создают меньше филоподий, и их механические свойства резко ухудшаются [6]. В структурах, подобных ламеллиподиям, предполагается, что фасцин организует актиновый цитоскелет на переднем крае, чтобы способствовать подвижности клеток [7].
Схема фашина, как молекула изображена на всем протяжении MBInfo
Структура белка Глобулярный белок массой 55 кДа, который является компонентом функционального модуля сшивающих актиновых филаментов. Fascin организует F-актин в плотно упакованные параллельные пучки на расстоянии примерно 8 нм друг от друга.Он также способствует боковому ветвлению актиновых филаментов и может сшивать актиновые филаменты без образования пучков [8]. Metazoans содержат три формы фасцина (например, фашин-1, -2 и -3), кодируемые тремя отдельными генами, в то время как беспозвоночные содержат одну форму фасцина (обзор в [9]). Фасцин содержит два актин-связывающих домена (ABD), по одному на каждом конце белка (см. Рисунок ниже) [10] [11] [12]. Фасцин связывается с актиновыми филаментами со стехиометрией в диапазоне от одной молекулы фасцина до 2-3 молекул актина (в ткани мозга) [1] или 1: 4 (in vitro) [2].
Локализация и функции Fascin
Устойчивый пул мономеров F-actin или слабо связанный F-actin способствует эффективной полимеризации и объединению актиновых филаментов с помощью фасцина (rev. [9]). Фосфорилирование фасцина в аминоконцевом сайте связывания актина протеинкиназой Cα (PKCα) ингибирует его способность связывать актин (в обоих сайтах) и образовывать пучки [10] [11]. Хотя фасцин претерпевает частые циклы ассоциации и диссоциации, а не стабильно связывается с актиновыми филаментами, этот процесс не зависит от состояния фосфорилирования [6].Скорость диссоциации фасцина от актина мала и, по-видимому, способствует уменьшению движения актиновых нитей и пучков, то есть увеличению жесткости актиновой сети [8].
Фасцин обнаружен в наиболее дистальных областях филоподий и ламеллиподий, и клеточное распределение фасцина внутри актиновых пучков (например, микрошипов и стрессовых волокон [13]), по-видимому, варьируется в зависимости от внеклеточного субстрата [14] [15] [16]; однако конкретные детали о том, как регулируется это распределение и сборка на актиновых филаментах, остаются в значительной степени неизвестными [6].
Сети, связанные с фасцином и α-актинином, содержат внутренние структурные особенности, которые управляют сортировкой белков
Основные моменты
- •
Очищенные связывающие белки внутренне сортируются в реконструированных актиновых сетях
- •
- g
act F к пучкам F-актина с различным расстоянием между филаментами
- •
Фацин и α-актинин облегчают собственное связывание, ингибируя при этом другие
- •
Компактные связки фасцинируют, эспин и фимбрин совместно сегрегируют от α-actinin
Резюме
Клетки собирают и поддерживают функционально различные сети актинового цитоскелета с различными организациями и динамикой актиновых филаментов за счет скоординированного действия различных наборов актин-связывающих белков.Биохимические и функциональные свойства различных актин-связывающих белков, как по отдельности, так и в комбинации, все больше изучаются. Напротив, то, как разные наборы актин-связывающих белков должным образом сортируются в разные сети актиновых филаментов, в первую очередь, не так хорошо изучено. Сортировка актин-связывающих белков критична для самоорганизации разнообразных динамических сетей актинового цитоскелета в общей цитоплазме. Используя методы восстановления in vitro, включая биомиметические анализы и многоцветную флуоресцентную микроскопию полного внутреннего отражения одной молекулы, мы обнаружили, что сортировка известных связывающих актин белков фасцина и α-актинина по разным сетям является внутренним поведением, свободным от сложной клеточной передачи сигналов. каскады.При смешивании фасцин и α-актинин взаимно исключают друг друга, способствуя их собственному рекрутированию и ингибируя рекрутирование другого, что приводит к образованию отдельных связанных с фасцином или α-актинином доменов.
